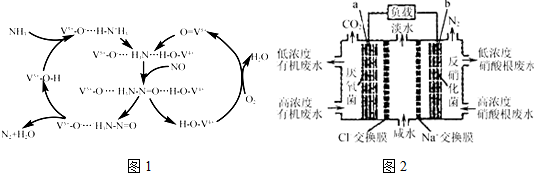
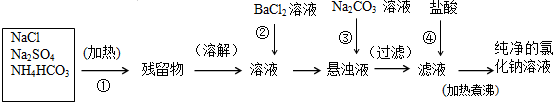
题目内容
11.下列溶液中粒子的物质的量浓度关系正确的是( )| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| B. | 20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.两溶液反应后生成溶质为碳酸钠,碳酸根离子部分水解,溶液呈碱性,则c(OH-)>c(HCO3-);
B.反应后溶质为等浓度的醋酸、醋酸钠和氯化钠,醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,钠离子浓度最大;
C.一水合氨为弱碱,则混合液中氨水过量,溶液呈碱性:;
D.反应后溶质为醋酸钠,根据醋酸钠溶液中的质子守恒判断.
解答 解:A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,反应后溶质为碳酸钠,碳酸根离子部分水解,溶液显示碱性,溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A正确;
B.20mL 0.1mol/LCH3COONa溶液与10mL 0.1mol/LHCl溶液混合后呈酸性,反应后溶质为等浓度的醋酸钠、醋酸和氯化钠,所得溶液中钠离子不水解,醋酸根离子的水解程度大于醋酸的电离程度,混合液呈酸性,但电离程度较小,则c(Na+)>c(CH3COO-)>c(CH3COOH),溶液中各离子浓度大小为:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+),故B错误;
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,一水合氨为弱碱,混合液中氨水过量,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可得:c(NH4+)>c(Cl-),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,反应后溶质为醋酸钠,根据质子守恒可得:c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、盐的水解原理及质子守恒的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

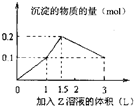
| A. | 偏铝酸钠、氢氧化钡、硫酸 | B. | 氯化铝、氯化镁、氢氧化钠 | ||
| C. | 氯化铝、氯化铁、氢氧化钠 | D. | 偏铝酸钠、氯化钡、硫酸 |
| A. | 2-甲基丙烷 | B. | 2,2,3,3-四甲基丁烷 | ||
| C. | 2,2-二甲基丁烷 | D. | 2,2-二甲基丙烷 |
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 血液透析是利用了胶体的性质 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 点燃爆竹后,硫燃烧生成SO3 |
| A. | 在KHC2O4溶液中,c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) | |
| B. | 在KHC2O4溶液中,c(HC2O4-)+c(C2O42-)=c(K+) | |
| C. | 草酸与酸性高锰酸钾溶液反应的速率先增大后减小 | |
| D. | 草酸分子中碳元素为+3价,易发生还原反应 |
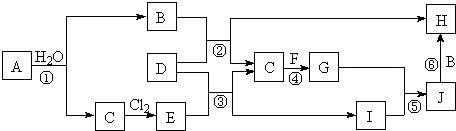
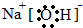 .
.