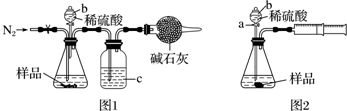
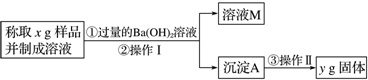
题目内容
18.相同条件下,对于浓度均为0.1mol/L的NaCl溶液和CH3COONa溶液,溶液中离子总数:NaCl溶液>CH3COONa溶液(填>、﹦、<).分析 NaCl是强酸强碱盐,不水解;而醋酸钠是弱酸强碱盐,能水解.根据两溶液中的电荷守恒来分析;
解答 解:0.1mol/L的NaCl溶液中的c(Na+)=0.1mol/L,则溶液中的电荷守恒有:c(Na+)+c(H+)=c(Cl-)+c(OH-);
0.1mol/L的CH3COONa溶液中的c(Na+)=0.1mol/L,溶液中的电荷守恒有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
两溶液中的c(Na+)相同,但由于氯化钠是强酸强碱盐,不水解,溶液显中性,而醋酸钠是弱酸强碱盐,能水解,溶液显碱性,故氯化钠溶液中的c(H+)大于CH3COONa溶液中的c(H+),则有:c(Cl-)+c(OH-)>c(CH3COO-)+c(OH-),故有NaCl溶液中c(Na+)+c(H+)+c(Cl-)+c(OH-)大于CH3COONa溶液中的c(Na+)+c(H+)+c(CH3COO-)+c(OH-);即溶液中离子总数:NaCl溶液>CH3COONa溶液,故答案为:>;
点评 本题考查了两盐溶液中的离子个数的大小比较,应从盐的种类来分析其能否水解,并从电荷守恒的角度入手,难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
9.某有机物的结构简式为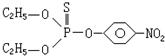 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 该有机物属于芳香烃 | B. | 该有机物易溶于水 | ||
| C. | 该有机物不能发生加成反应 | D. | 该有机物能发生取代反应 |
3.下列说法不正确的是( )
| A. | Na2CO3比NaHCO3稳定得多 | |
| B. | NaHCO3比Na2CO3难溶于水 | |
| C. | 用物质的量相同的苏打和小苏打可得到相同质量的CO2 | |
| D. | 石灰水既能和Na2CO3反应,又能与NaHCO3反应,且反应原理相同 |
10.下列离子方程式正确的是( )
| A. | 氢氧化铁与盐酸反应OH-+H+═H2O | |
| B. | 次氯酸钠溶液中通入少量CO2 2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 硫酸氢钠溶液中加入氢氧化钡溶液至沉淀完全 Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
7.下列事实与胶体知识有关的是
①晨雾中看见叶缝透过光束的通路 ②用明矾净水 ③一支钢笔使用不同牌号的蓝黑墨水易出现堵塞 ④静电除尘 ⑤豆浆做豆花 ⑥血液透析 ⑦在江河入海口处容易形成沙洲( )
①晨雾中看见叶缝透过光束的通路 ②用明矾净水 ③一支钢笔使用不同牌号的蓝黑墨水易出现堵塞 ④静电除尘 ⑤豆浆做豆花 ⑥血液透析 ⑦在江河入海口处容易形成沙洲( )
| A. | ①②⑤⑦ | B. | ①③④⑤⑥ | C. | ①③⑤⑥⑦ | D. | 全部都有关 |