��Ŀ����
����Ŀ���������״���;����㷺��Խ��Խ�����̼ҵĹ�ע����ҵ�ϼ״��ĺϳ�;�����ֶ���������ʵ������ģ��״��ϳɷ�Ӧ,��2 L�ܱ������ڣ�400 ��ʱ������ӦCO(g)+2H2(g) ![]() CH3OH(g)����ϵ��n(CO)��ʱ��ı仯�����
CH3OH(g)����ϵ��n(CO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
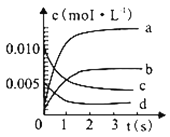
��1��ͼ�б�ʾCH3OH �ı仯��������_______��
��2�����д�ʩ������߷�Ӧ���ʵ���_________(������Ӧ��ĸ���)��
a.�����¶� b.������� c.����ѹǿ d.��ʱ�����CH3OH
��3������������˵����Ӧ�ﵽƽ��״̬����__________(������Ӧ��ĸ���)��
a.CO��H2��Ũ�ȱ��ֲ��� b.v(H2)=2 v(CO)
c.CO�����ʵ����������ֲ��� d.�����������ܶȱ��ֲ���
e.ÿ����1molCH3OH��ͬʱ��2molH-H������
��4��CH3OH��O2�ķ�Ӧ�ɽ���ѧ��ת��Ϊ���ܣ��乤��ԭ����ͼ��ʾ��ͼ��CH3OH��__________����A��B��ͨ�룬b���ĵ缫��Ӧʽ��__________��

���𰸡�b d ac A O2+4e-+2H2O=4OH-
��������
��1��CH3OH�Dz�����ŷ�Ӧ�������ʵ�������ƽ��ʱ�����ʵ�������CO���ʵ����ı仯����n(CO)��ͼ����CO�����ʵ���0-3s�仯=0.02mol-0.007mol=0.013mol�����CO�仯Ũ��Ϊ0.013mol��2L=0.0065mol/L��CO�ͼ״���������ͬ������ͼ����ֻ��b���ϣ���ˣ��������b��
��2��d������CH3OH������Ӧ���ʲ��䣬�淴Ӧ���ʼ�С�����������߷�Ӧ���ʣ�a�������¶ȿ��Լӿ췴Ӧ���ʣ�b��Ӵ��������ͻ�ܣ��ӿ췴Ӧ���ʣ�c������ѹǿ�൱�����������Ũ�ȣ���Ӧ���ʼӿ죬�ʴ�ѡd��
��3��a.CO��H2��Ũ�ȱ��ֲ��䣬�����÷�Ӧ����ƽ��״̬����ȷ��b.v(H2)=2v(CO)��û�б�ʾ���淴Ӧ���ʣ���������ж�ƽ�⣬����c.CO�����ʵ����������ֲ����ʾCO�ĺ������䣬���÷�Ӧ����ƽ��״̬����ȷ��d.�����ܶȵ�������������������������������ڸ÷�Ӧ�������壬�������������䣬�������Ǻ��ݣ�����ܶ�ʼ�ղ��䣬���Բ����ж�ƽ�⣬����e.ÿ����1molCH3OH��ͬʱ��2molH-H�����ѣ����ݷ�Ӧ�ص㣬���߶���ʾ����Ӧ���ʣ���������ж�ƽ�⣬���ʴ�ѡac��
��4��������a����b˵��aΪ������bΪ������CH3OH��O2�ķ�Ӧ�ɽ���ѧ��תΪ���ܣ��״�ʧ���ӷ���������Ӧ������CH3OH��Aͨ�룬Bͨ��������b�缫�����ĵ缫��ӦʽΪ�����õ������������������ӣ��缫��ӦΪ��O2+4e-+2H2O=4OH-��