题目内容
【题目】某温度下,将H2(g)和I2(g)各0.9 mol的气态混合物充入2 L的密闭容器中,充分反应,5 min后达到平衡,测得c(HI)=0.3 mol/L。(写出计算过程)
(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率________________。
(2)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2 mol,求达到平衡时I2(g)的物质的量浓度___________________。
【答案】 0.03mol/(L·min) 2/3或0.67mol/L
【解析】根据已知数据可列如下关系:
H2(g) + I2(g)![]() 2HI(g)
2HI(g)
初始浓度(mol/L) 0.45 0.45 0
浓度变化(mol/L) 0.15 0.15 0.30
平衡浓度(mol/L) 0.30 0.30 0.30
(1)v(H2)= ![]()
(2)化学平衡常数只与温度有关,保持温度不变,平衡常数也不变,
该反应的平衡常数K=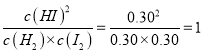
当向上述容器中充入H2(g)和I2(g)各2 mol时,设平衡时I2(g)的物质的量浓度x mol/L,则有如下关系:
H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
初始浓度(mol/L) 1 1 0
变化浓度(mol/L) 1-x 1-x 2(1-x)
平衡浓度(mol/L) x x 2(1-x)
所以 K=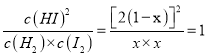 ,x=2/3(或0.67)
,x=2/3(或0.67)
(2)另解:该反应前后气体体积相等,若等比例增大反应物的量,相当于加压,但该化学平衡不移动,所以(1)、(2)两种情况下,起始浓度与平衡浓度是成正比的,
由I2(g)浓度数据可得: ![]() x=2/3(或0.67)mol/L
x=2/3(或0.67)mol/L
答:(1)用H2(g)表示的反应速率为0.03mol/(L·min),(2)达到平衡时I2(g)的物质的量浓度2/3 mol/L(或0.67mol/L)