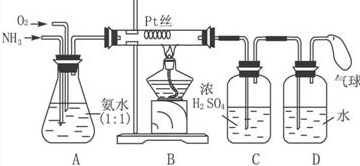
题目内容
15.称取两份铝粉,第一份加入足量的浓NaOH(aq),第二份加入足量的HCl(aq),如果放出等体积的气体(在同温同压下测定),则两份铝粉的质量之比为( )| A. | 1:2 | B. | 1:3 | C. | 3:2 | D. | 1:1 |
分析 因酸、碱均足量,则Al完全反应,生成氢气的量由Al来决定,并利用同温、同压下放出气体的体积比等于物质的量之比来解答.
解答 解:铝片和盐酸或烧碱反应中,酸、碱均足量,
由2Al~3H2↑,则铝片质量相同,则产生的氢气的体积和物质的量均相同,
则同温、同压下放出气体的体积比为1:1,即两份铝片的物质的量之比为1:1,其质量之比为1:1,
故选D.
点评 本题考查Al的化学性质,明确Al与酸、碱的反应及酸、碱足量得出Al与氢气的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
5.下列物质属于弱电解质的是( )
| A. | Cl2 | B. | CO2 | C. | NH3•H2O | D. | AgCl |
6.除去下列物质中的少量杂质,所用方法正确的是( )
| 选项 | 物质(括号内为杂质) | 除去杂质的方法 |
| A | KCl(MnO2) | 加水溶解,过滤,洗涤,干燥 |
| B | FeSO4溶液(CuSO4) | 加入适量的锌粉,过滤 |
| C | NaCl溶液(CuCl2) | 加入过量的NaOH溶液,过滤 |
| D | O2(H2O) | 将混合气体通过盛有足量浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
10.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,23gNO2和N2O4的混合气体中含有的N原子数目为0.75NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 7.8 g Na2S和Na2O2中含有的阴离子数大于0.1NA | |
| C. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
7.下列事实不能说明非金属性Cl>I的是( )
| A. | Cl2+2I-→2Cl-+I2 | B. | 酸性:HClO3>HIO3 | C. | 酸性:HClO4>HIO4 | D. | 稳定性:HCl>HI |
4.下列各项所述内容对应的图象正确的是( )
| A. |  向含有H+,Al3+,Mg2+的溶液中,逐渐加入NaOH溶液 | |
| B. | 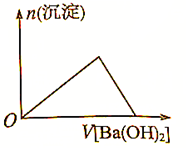 向Al2(SO4)3溶液中加入Ba(OH)2溶液 | |
| C. |  物质的量相等的镁和铝分别与等浓度、等体积的过量稀硫酸反应 | |
| D. |  向AlCl3溶液中加氨水 |