题目内容
【题目】按要求完成下列各题:
(1)微粒铵根14N2H4+中的中子数是___________________ ,核外电子数是_____。
(2)写出 N2的电子式_________________,画出HClO分子的结构式_________________
CO2的电子式________________;Na2O2的电子式为___________________
(3)如图是元素周期表的一个方格  ,其中19.00的意义是______________
,其中19.00的意义是______________
(4) 25℃,101 kPa,1g C2H2气体充分燃烧生成气体CO2和液态H2O,放出125kJ的热量,写出C2H2燃烧热的热化学方程式_________________
【答案】11 10 ![]() H-O-Cl
H-O-Cl ![]()
![]() F元素的相对原子量 C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-3250kJ·mol-1
F元素的相对原子量 C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-3250kJ·mol-1
【解析】
(1)依据质量数=质子数+中子数,则14N2H4+中中子数为[14-7+(2-1)×4]=11;该离子为阳离子,其核外电子数=质子数-所带电荷数=(7+4-1)=10;
(2)N2中N和N之间以叁键形式结合,N2的电子式为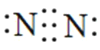 ;HClO的结构式为H-O-Cl;CO2中C和O之间以双键形式结合,即CO2的电子式为
;HClO的结构式为H-O-Cl;CO2中C和O之间以双键形式结合,即CO2的电子式为![]() ;Na2O2是离子化合物,含有离子键和非极性键,其电子式为
;Na2O2是离子化合物,含有离子键和非极性键,其电子式为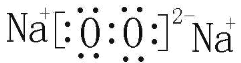 ;
;
(3)19.00表示F元素的相对原子量;
(4)根据燃烧热的定义,1molC2H2燃烧放出的热量为125kJ×26=3250kJ,表示C2H2燃烧热的热化学方程式为C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-3250kJ·mol-1。

练习册系列答案
相关题目