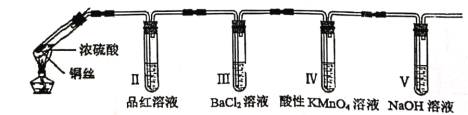
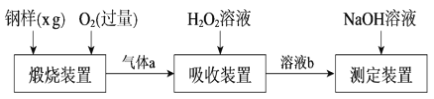
题目内容
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑该反应中还原剂是________________。(填化学式)
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_____________。
②每生成2mol FeO42-转移________mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和1 mol FeBr2的溶液中通入2.5 mol Cl2,此时依次被氧化的离子是__________,被氧化的离子对应的物质的量之比是________________。
(2)若向含a mol FeI2和b mol FeBr2的混合溶液中通入c mol Cl2,当该混合溶液与通入的Cl2恰好完全反应时,a、b、c的关系为______________________(用含a、b、c的代数式表示)。
【答案】FeSO4 Na2O2 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 6 0.25 I-、Fe2+、Br- 2:2:1 c=1.5a + 1.5b
【解析】
I.(1)在2FeSO4+6Na2O2=2NaFeO4+2Na2O+2Na2SO4+O2↑中Fe、O元素的化合价升高,O元素的化合价降低,利用氧化还原反应规律判断;
(2) ①湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,根据化合价升降总数相等配平参加氧化还原反应的微粒,再结合电荷守恒、原子守恒配平其它微粒的系数;
②根据Fe元素化合价变化计算转移电子,还原产物为Cl-,根据Cl元素化合价变化计算生成Cl-的物质的量;
II.由2Fe3++2I-=2Fe2++I2和2Fe2++Br2=2Br-+2Fe3+可知,微粒的还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气首先和I-反应,然后再和Fe2+反应,最后和Br-反应。根据FeI2、FeBr2、Cl2的物质的量,结合反应的离子方程式计算。
I.(1)反应中Fe元素化合价由+2价升高为+6价,被氧化,FeSO4为还原剂;过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价,过氧化钠既是氧化剂也是还原剂。故该反应中的还原剂为FeSO4和Na2O2;
(2) ①湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,Fe元素化合价升高3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低2价,化合价升降最小公倍数为6,故Fe(OH)3和FeO42-的系数为2,ClO-和Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②根据Fe元素化合价变化可知:每产生1mol FeO42-,电子转移3mol,则生成2mol FeO42-转移6mol电子;
若反应过程中转移了0.5mol电子,则还原产物的物质的量为n(Cl-)=0.5mol÷2=0.25mol;
II. (1) ①根据2Fe3++2I-=2Fe2++I2和2Fe2++Br2=2Br-+2Fe3+可知,微粒的还原性强弱顺序是:I->Fe2+>Br-。向溶液中通入氯气,氯气首先和I-反应,然后再和Fe2+反应,最后和Br-反应。向含有1mol FeI2和1mol FeBr2的溶液中通入2.5mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol I-完全反应需要氯气1mol,然后发生反应Cl2+2Fe2+=2Cl-+2Fe3+,2mol Fe2+反应需要1mol氯气,还有0.5mol氯气,发生反应:Cl2+2Br-=2Cl-+Br2,消耗1molBr-,所以被氧化的离子依次是2molI-、2molFe2+、1mol Br-,所以它们的物质的量的比是2:2:1;
②a mol FeI2完全被氧化转移3amol电子,b mol FeBr2完全被氧化转移3bmol电子,由得失电子守恒可知,当I-、Fe2+、Br-完全被氧化时,消耗氯气的物质的量为n(Cl2)=0.5×(3a+3b)mol,即c=![]() 。
。

【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情况表明反应达到平衡状态的是________(填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________。
(3)实验3和实验2相比,改变的条件是_____________。
II.(1)硫化钠溶液具有较强碱性,其原因是___________(用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 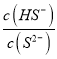 的值增大,可采取的措施是___________(填序号)
的值增大,可采取的措施是___________(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体