题目内容
6. 一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$
根据题意完成下列填空.
(1)写出该反应的化学方程式:C(s)+H2O(g)?CO(g)+H2(g);若温度升高,K增大,该反应是吸热(选填“吸热”或“放热”)反应.
(2)下列能判断该反应一定达到平衡状态的是ab(选填编号).
a.v正(H2O)=v逆(H2)
b.容器中气体的密度不随时间改变
c.消耗n molH2同时消耗nmolCO
d.容器中物质的总物质的量不随时间改变
(3)该反应的v正随时间变化的关系如图.t2时刻改变了某种条件,改变的条件可能是升高温度或增大水蒸气浓度.
(4)实验测得t2时刻容器内有1molH2O,5min后H2O的物质的量是0.8mol.则这5min内H2O的平均反应速率为0.004mol/(L﹒min).
分析 (1)根据化学平衡常数表达式及元素守恒知,反应物还有C,所以该反应方程式为C(s)+H2O(g)?CO(g)+H2(g);升高温度,平衡向吸热反应方向移动;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;
(3)改变条件时反应速率增大,改变的条件可能是温度、压强、反应物浓度;
(4)反应速率=$\frac{\frac{△n}{V}}{△t}$.
解答 解:(1)根据化学平衡常数表达式及元素守恒知,反应物还有C,所以该反应方程式为C(s)+H2O(g)?CO(g)+H2(g);升高温度,平衡向吸热反应方向移动,K增大说明平衡正向移动,所以正反应是吸热反应,故答案为:C(s)+H2O(g)?CO(g)+H2(g); 吸热;
(2)a.当v正(H2O)=v逆(H2)=v逆(H2O)时,正逆反应速率相等,所以反应达到平衡状态,故正确;
b.反应前后气体质量改变、容器体积不变,当容器中气体的密度不随时间改变,正逆反应速率相等,所以达到平衡状态,故正确;
c.无论反应是否达到平衡状态都存在消耗n molH2同时消耗nmolCO,所以不能据此判断平衡状态,故错误;
d.无论反应是否达到平衡状态容器中物质的总物质的量都不随时间改变,所以不能据此判断平衡状态,故错误;
故选a b;
(3)改变条件时反应速率增大,改变的条件可能是升高温度、增大压强、增大反应物浓度,
故答案为:升高温度;增大水蒸汽的浓度;
(4)反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1-0.8}{10}}{5}$=0.004mol/(L﹒min),
故答案为:0.004mol/(L﹒min).
点评 本题考查平衡状态判断、反应速率计算、化学反应速率因素等知识点,侧重考查基本理论及计算,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,注意该反应方程式特点,题目难度不大.

| A. |  属于酯类 属于酯类 | B. | 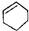 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 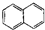 属于脂环化合物 属于脂环化合物 | D. | 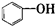 属于芳香烃 属于芳香烃 |
(2 ) 有A、B、C、D四种金属,已知用B与C相连作电极放入硫酸铜溶液中C的质量增加.B与A相连插入稀硫酸时A不断溶解.按下表中装置进行实验,根据实验现象填表:
| 装置 |  |  |
| 现象 | 电子流入C极 | A上有气体产生 |
| 正极反应式 | ||
| 四种金属由弱到强顺序 | ||
A SO2 与SO3浓度相等时 B 气体的密度恒定时 C 2V正(O2 )=V逆(SO3)

| A. | Pt片c上发生的反应为2H++2e-=H2↑,c周围变为红色 | |
| B. | b电极周围有白色沉淀生成 | |
| C. | Z单质的金属活动性较Cu强 | |
| D. | 装置A、B之间倒置的U形管,是沟通两装置的离子通道 |
| A. | 用醋酸检验牙膏中的摩擦级碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | 金属钠与水剧烈反应:Na+2H2O═Na++OH-+H2↑ |
| A. | 硅可用作半导体材料 | |
| B. | 明矾可用作净水剂 | |
| C. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| D. | 煤是一种清洁能源,直接燃烧不会造成环境污染 |
| A. | 用食醋清洗水瓶内壁附着水垢(CaCO3) | |
| B. | 用小苏打发酵面粉制作馒头 | |
| C. | 自来水中通入少量Cl2进行杀菌消毒 | |
| D. | 用SO2漂白食品 |
| A. | 纯净物 | B. | 混合物 | C. | 化合物 | D. | 单质 |