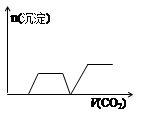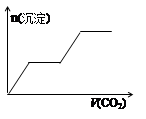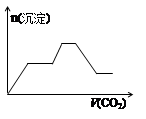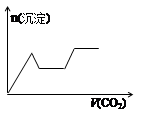题目内容
某抗酸药每片含碳酸钙500mg,氢氧化镁174mg,该药可中和多少克溶质质量分数为7.3%盐酸?
8g
解析试题分析:每片含碳酸钙500mg,氢氧化镁174mg
则碳酸钙的物质的量是0.5g÷100g/mol=0.005mol
氢氧化镁的物质的量是0.174g÷58g/mol=0.003mol
所以根据方程式可知
CaCO3+2HCl=CaCl2+CO2↑+H2O
1mol 2mol
0.005mol 0.01mol
Mg(OH)2+2HCl=MgCl2+2H2O
1mol 2mol
0.003mol 0.006mol
所以消耗氯化氢的物质的量是0.016mol
氯化氢的质量是0.016mol×36.5g/mol=0.584g
则盐酸的质量是0.584g÷7.3%=8g
考点:考查根据方程式进行的有关计算
点评:该题是基础性试题的考查,难度不大。试题贴近生活实际,有利于调动学生的学习兴趣,有助于培养学生规范的答题能力。明确反应的原理是答题的根据。

I .用序号回答下列各题:
① 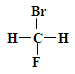 和
和 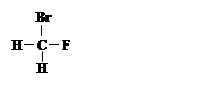
②1H—、2H、3H +、D2 ③淀粉和纤维素
④ 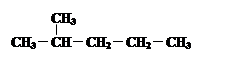 和
和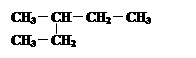
⑤16O2、18O3 ⑥235U、238U
其中互为同位素的是 。
互为同素异形体的是 。
互为同分异构体的是 。
是同一种化合物的是 。
II. 请选择合适的试剂检验某物质中是否含括号内物质:
| 序号 | 原物质(需检验物质) | 试剂 |
| ① | CO2(SO2) | |
| ② | 乙醇(水) | |
| ③ | 直馏汽油( 裂化汽油) | |
Ⅲ.某元素R气态氢化物化学式为HnR。若最高价氧化物对应水化物分子中有b个氧原子,则其最高价氧化物对应水化物化学式通常表达为 。(含n和b)
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是________(填物质名称)。
(2)“三酸”与“两碱”之间的反应,若用化学方程式表示有六个(酸过量时) ,若用离子方程式表示却只有两个,请写出这两个离子方程式:(酸过量时)_____________________________、______________________。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________。
| A.Au | B.Cu |
| C.Al | D.Fe |
①________,②Na2CO3,③________,④NaHCO3。
现有下列十种物质:①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | | 氧化物 | | | 电解质 |
| 属于该类的物质 | ② | | ⑧⑨ | ⑦ | |
 H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。(3)⑩在水中的电离方程式为 ,17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为 ,SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程式为 。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是 (填化学式),还原剂与氧化剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。
该反应的离子方程式为 。
下列离子方程式正确的是
| A.等物质的量的Ba(OH)2与明矾[KAl(SO4)2·12H2O]加入足量水中: 3Ba2++6OH-+2Al3++3SO  ===3BaSO4↓+2Al(OH)3↓ ===3BaSO4↓+2Al(OH)3↓ |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O |
C.H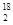 O中投入Na2O2固体:2H O中投入Na2O2固体:2H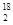 O+2Na2O2===4OH-+4Na++18O2↑ O+2Na2O2===4OH-+4Na++18O2↑ |
| D.CuCl2溶液中加入H2S溶液:Cu2++S2-===CuS↓ |
下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由于反应物的浓度不同而引起的是
| A.Fe+H2SO4 | B.Cu+HNO3 | C.NaOH+ CO2 | D.AlCl3 +NaOH |
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中: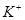 、 、 、 、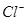 、 、 |
B.室温下, 的盐酸中: 的盐酸中: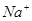 、 、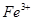 、 、 、 、 |
C.含有 的溶液中: 的溶液中: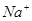 、 、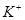 、 、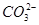 、 、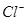 |
D.由水电离产生的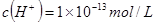 的溶液中: 的溶液中: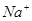 、 、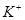 、 、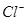 、 、 |
 ④氕、氘、氚
④氕、氘、氚