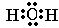题目内容
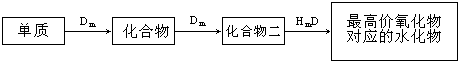
已知Cl2和热的NaOH溶液反应生成NaClO3、H2O、X,则X为
- A.NaCl
- B.NaClO4
- C.ClO2
- D.NaClO
A
分析:Cl2和热的NaOH溶液反应生成NaClO3、H2O,说明在加热条件下氯气与NaOH发生氧化还原反应,为歧化反应,以此判断产物.
解答:Cl2和热的NaOH溶液反应生成NaClO3、H2O,说明在加热条件下氯气与NaOH发生氧化还原反应,为歧化反应,当Cl元素把被氧化时生成NaClO3,被还原时,化合价降低,只能生成NaCl,
故选A.
点评:本题考查氯气的性质以及氧化还原反应,题目难度不大,注意根据氧化还原反应的特点判断反应的可能产物.
分析:Cl2和热的NaOH溶液反应生成NaClO3、H2O,说明在加热条件下氯气与NaOH发生氧化还原反应,为歧化反应,以此判断产物.
解答:Cl2和热的NaOH溶液反应生成NaClO3、H2O,说明在加热条件下氯气与NaOH发生氧化还原反应,为歧化反应,当Cl元素把被氧化时生成NaClO3,被还原时,化合价降低,只能生成NaCl,
故选A.
点评:本题考查氯气的性质以及氧化还原反应,题目难度不大,注意根据氧化还原反应的特点判断反应的可能产物.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
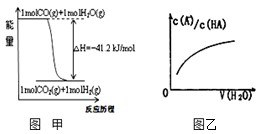 关于下列各图的叙述错误的是( )
关于下列各图的叙述错误的是( )| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2?2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
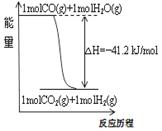
关于下列各图的叙述错误的是 ( )
 |

| 化学方程式 | 平衡常数K |
| F2+H2 | 6.5×1095 |
| Cl2+H2 | 2.6×1033 |
| Br2+H2 | 1.9×1019 |
| I2 + H2 | 8.7×102 |
图 甲 表 乙 图 丙
A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)> c(Na+)>c(H+)>c(OH-)
C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况