题目内容
15.分别完全沉淀等物质的量浓度的KCl、CaCl2和AlCl3溶液中的Cl-,消耗相同物质的量浓度为AgNO3溶液的体积之比为3:2:1,则KCl、CaCl2、AlCl3溶液的体积之比为( )| A. | 6:3:2 | B. | 1:1:1 | C. | 9:3:1 | D. | 3:2:1 |
分析 假设硝酸银的物质的量浓度为cmol/L,完全沉淀相同体积的KCl、CaCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3溶液的体积分别为3L、2L、1L,发生反应Ag++Cl-=AgCl↓,令NaCl、MgCl2、AlCl3溶液的体积分别为xL、yL、zL,溶液浓度均为amol/L,根据方程式列式计算.
解答 解:假设硝酸银的物质的量浓度为cmol/L,完全沉淀相同体积的KCl、CaCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3溶液的体积分别为3L、2L、1L,
令KCl、CaCl2、AlCl3溶液的浓度分别为xL、yL、z/L,溶液浓度均为amol/L,根据Ag++Cl-=AgCl↓,可知:
3c=xa,2c=y×2a,1c=z×3a,故x:y:z=9:3:1,
故选:C.
点评 本题考查了物质的量浓度的计算、离子方程式的有关计算,明确发生的离子反应是解题关键.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
5.下列离子方程式正确的是( )
| A. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 用食醋除去水瓶中的水垢:CO${\;}_{3}^{2-}$+2CH3COOH═2CH3COO-+H2O+CO2↑ | |
| C. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | FeCl3溶液中加入过量的Cu粉:2Fe3++Cu═Cu2++2Fe2+ |
6.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌锰碱性电池以KOH为电解质,电池总反应式为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2.下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+H2O+e-═MnOOH+OH- | |
| C. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g | |
| D. | 锌锰碱性电池是二次电池,所以性能比普通锌锰电池好 |
4.在体积为2L的密闭容器内合成氨,已知在时间t内,氨的物质的量增加了0.6mol,在此时间段内,用氢气表示的平均反应速率是0.45mol•L-1•s-1,则t是( )
| A. | 0.44 s | B. | 1 s | C. | 1.33 s | D. | 2 s |
5.下列说法中正确的是( )
| A. | 凡是卤代烃一定能发生消去反应 | |
| B. | 能发生消去反应的物质一定是卤代烃 | |
| C. | 所有卤代烃都能在适当条件下发生水解反应 | |
| D. | 乙基是溴乙烷的官能团 |
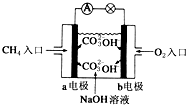 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.