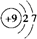题目内容
6.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌锰碱性电池以KOH为电解质,电池总反应式为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2.下列说法错误的是( )| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+H2O+e-═MnOOH+OH- | |
| C. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g | |
| D. | 锌锰碱性电池是二次电池,所以性能比普通锌锰电池好 |
分析 A、根据原电池中失电子的一极为负极判断;
B、根据正极得电子发生还原反应书写;
C、根据锌与转移电子的关系计算;
D、锌锰碱性电池不能冲电,属于一次电池.
解答 解:A、原电池中失电子的一极为负极,Zn转化为Zn(OH)2,化合价升高失电子,做负极,故A正确;
B、正极得电子发生还原反应,电极反应式为:MnO2+H2O+e-═MnOOH+OH-,故B正确;
C、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则外电路中每通过0.2mol电子,锌的质量理论上减小6.5g,故C正确;
D、锌锰碱性电池不能冲电,属于一次电池,故D错误;
故选D.
点评 本题考查了化学电源新型电池,明确原电池原理是解本题关键,难点的电极反应式的书写,要结合电解质溶液的酸碱性书写,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
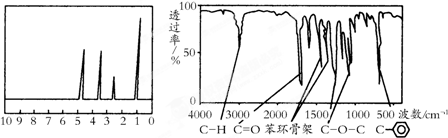

| A. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| B. | A在一定条件下可与4 mol H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物不止1种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
17.下列说法正确的是( )
| A. | 烷烃就是饱和烃 | |
| B. | 乙烷分子中的两个C原子共线,而C,H八个原子共面 | |
| C. | C3H8分子中的三个碳原子可能共线,但所有的原子不可能共面 | |
| D. | C20H42一定属于烷烃 |
14.根据元素周期表中元素性质变化规律,ⅥA族元素不可能有的性质是( )
| A. | 从上到下非金属性减弱 | B. | 从上到下元素原子半径增大 | ||
| C. | 从上到下单质熔沸点升高 | D. | 该族元素都有的化合价为+6、-2 |
18.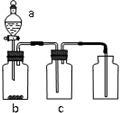 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 浓硫酸 |
| C | O2 | 双氧水 | 二氧化锰 | 碱石灰 |
| D | CO2 | 稀盐酸 | CaCO3 | 饱和NaHCO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
15.分别完全沉淀等物质的量浓度的KCl、CaCl2和AlCl3溶液中的Cl-,消耗相同物质的量浓度为AgNO3溶液的体积之比为3:2:1,则KCl、CaCl2、AlCl3溶液的体积之比为( )
| A. | 6:3:2 | B. | 1:1:1 | C. | 9:3:1 | D. | 3:2:1 |
16.对仪器的使用和操作,下列说法正确的是( )
| A. | 容量瓶在使用前一定要检漏、洗涤并烘干 | |
| B. | 使用胶头滴管时,特殊情况下也可把滴管插入到溶液中 | |
| C. | 取过程中,不需要打开分液漏斗的玻璃塞,以防止其漏气 | |
| D. | 蒸馏时,冷却水从冷凝管最热一端进入,这样冷凝效果好 |