题目内容
【题目】I.在298K、100 kPa时,已知:①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g) ![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
则△H1、△H2、△H3间的关系是_________,K1、K2、K3间的关系是___________。
II.高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。试回答下列问题:
Fe(s)+CO2(g) △H>0。试回答下列问题:
(1)写出该反应的平衡常数表达式________。
(2)升高温度,该反应的平衡常数K值将________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将________填“增大”、“减小”、“不变”)。
(3)已知1100℃时该反应的平衡常数K=0.263。在该温度测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时该化学反应的速度是v(正)______ v(逆)(填”>”、“<”、“=”),原因是________。
(4)保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值________0.263(填”>”、“<”、“=”)。
【答案】△H1=△H3-2△H2 K1=![]()
![]() 增大 减小 > 该条件下气体的浓度商小于该温度下的化学平衡常数,说明反应正向进行 =
增大 减小 > 该条件下气体的浓度商小于该温度下的化学平衡常数,说明反应正向进行 =
【解析】
I.根据盖斯定律,将已知热化学方程式叠加,可得三者关系;利用化学平衡常数的含义,判断三个反应的平衡常数的关系;
II.(1)根据化学平衡概念为生成物浓度幂之积与反应物浓度幂之积之比书写,注意固体不写入表达式;
(2)利用该反应为吸热反应,根据平衡移动原理分析温度对平衡的影响,判断平衡常数、固体质量变化情况;
(3)根据浓度计算浓度商,结合平衡常数进行比较判断反应进行的方向;
(4)平衡常数只受温度影响,温度不变,平衡常数不变。
I.①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g)![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
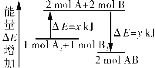
根据盖斯定律,将③-2×②,整理可得①:2H2O(g)![]() O2(g)+2H2(g),所以三个反应的反应热关系式为:△H1=△H3-2△H2;
O2(g)+2H2(g),所以三个反应的反应热关系式为:△H1=△H3-2△H2;
K1=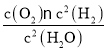 ,K2=
,K2=![]() ,则K22=
,则K22=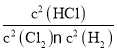 ,K3=
,K3=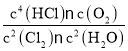 ,
,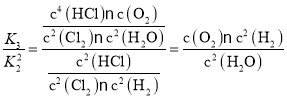 =K1;
=K1;
II.(1)反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的化学平衡常数表达式K=
Fe(s)+CO2(g)的化学平衡常数表达式K=![]() ;
;
(2)该反应的正反应是吸热反应,升高温度,化学平衡正向移动,则该反应的平衡常数K值将增大,固体由FeO变为Fe,所以生成的固体铁的质量会比原来氧化亚铁的质量少;
(3)1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,,浓度商Qc=![]() =0.25<K=0.263,说明反应正向进行,反应未达到平衡,因此v(正)>v(逆);
=0.25<K=0.263,说明反应正向进行,反应未达到平衡,因此v(正)>v(逆);
(4)平衡常数只受温度影响,温度不变,则反应的平衡常数不变,因此保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K=0.263。