题目内容
2.22.0g K2R中含0.4mol K+,则K2R的摩尔质量为110g/mol,R的相对原子质量为32;所含R的质量为3.2g的K2R,其物质的量为0.1mol.分析 K2R中含0.4mol K+,则K2R的物质的量为0.2mol,根据M=$\frac{m}{n}$计算K2R的摩尔质量,进而计算R的相对原子质量;根据n=$\frac{m}{M}$计算R原子物质的量,K2R的物质的量与R原子物质的量相等.
解答 解:22.0g K2R中含0.4mol K+,则K2R的物质的量为$\frac{0.4mol}{2}$=0.2mol,故K2R的摩尔质量为$\frac{22.0g}{0.2mol}$=110g/mol,R的相对原子质量为110-39×2=32;3.2g R原子物质的量为$\frac{3.2g}{32g/mol}$=0.1mol,n(K2R)=n(R)=0.1mol,
故答案为:110g/mol;32;0.1mol.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算.

练习册系列答案
相关题目
13.下列有关气体摩尔体积的描述中正确的是( )
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4 L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L/mol | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
10.下列叙述及解释正确的是( )
| A. | 2NO2(g)(红棕色)???N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | H2(g)+I2(g)???2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 | |
| C. | FeCl3+3KSCN???Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | 对于N2+3H2???2NH3,平衡后,压强不变,充入O2,平衡左移 |
7.下列物质间的转化可由一步反应完成的是( )
| A. | SiO2→H2SiO3 | B. | Cu(OH)2→Fe(OH)3 | C. | CaCO3→Na2CO3 | D. | K2O→KOH |
14.下列属于苯的同系物的是( )
| A. | 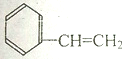 | B. | 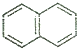 | C. |  | D. | 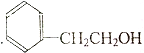 |
16.VL MgCl2溶液中,含Mg2+为mg,则该溶液中Cl-的物质的量浓度为( )
| A. | $\frac{m}{V}$mol•L-1 | B. | $\frac{m}{24V}$mol•L-1 | C. | $\frac{m}{12V}$mol•L-1 | D. | $\frac{m}{48V}$mol•L-1 |
17.下列各物质中,完全燃烧时生成的二氧化碳与水的物质的量之比为2:1的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 苯 | D. | 乙醇 |