题目内容
16.VL MgCl2溶液中,含Mg2+为mg,则该溶液中Cl-的物质的量浓度为( )| A. | $\frac{m}{V}$mol•L-1 | B. | $\frac{m}{24V}$mol•L-1 | C. | $\frac{m}{12V}$mol•L-1 | D. | $\frac{m}{48V}$mol•L-1 |
分析 根据n=$\frac{m}{M}$计算出镁离子的物质的量,再根据氯化镁的化学式计算出氯离子的物质的量,最后根据c=$\frac{n}{V}$计算出氯离子的物质的量浓度.
解答 解:mg镁离子的物质的量为:$\frac{mg}{24g/mol}$=$\frac{m}{24}$mol,
根据化学式MgCl2可知,VL该氯化镁溶液中含有氯离子的物质的量为:$\frac{m}{24}$mol×2=$\frac{m}{12}$mol,
该溶液中氯离子的物质的量浓度为:$\frac{\frac{m}{12}mol}{VL}$=$\frac{m}{12V}$mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为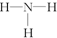 | ||
| C. | HCl的电子式为 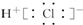 | D. | H2O中含有离子键 |
11.下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
(1)写出C元素在周期表中的位置第三周期ⅦA族,写出D元素最高价氧化物的水化物电子式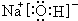 ;
;
(2)写出B单质与水反应的离子方程式Cl2+H2O=Cl-+H++HClO;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式2Na2O2+2CO2═2Na2CO3+O2;
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为O2+2H2O+4e-═4OH-;
(5)若使用Y-空气燃料电池精炼铜,当得到精铜80g时,燃料电池中转移的电子数为2.5NA.
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
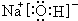 ;
;(2)写出B单质与水反应的离子方程式Cl2+H2O=Cl-+H++HClO;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式2Na2O2+2CO2═2Na2CO3+O2;
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为O2+2H2O+4e-═4OH-;
(5)若使用Y-空气燃料电池精炼铜,当得到精铜80g时,燃料电池中转移的电子数为2.5NA.
8.下列有关化学用语使用正确的是( )
| A. | 碳酸氢钠的水解方程式:HCO3-+H2O=CO32-+H3O+ | |
| B. | 在稀溶液中,酸跟碱反应生成1mol水时放出57.3KJ的热量,则稀盐酸与澄清石灰水发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| C. | 向NaHSO4溶液中加入过量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 用Na2CO3溶液吸收少量SO2的离子方程式:CO32-+SO2═CO2+SO32- |
5.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
| A. | NO(NO2)--通入足量水中,再用向上排空气法收集气体 | |
| B. | NaHCO3溶液(Na2CO3)--通入过量CO2 | |
| C. | Cl2(HCl)--用排饱和NaCl溶液的方法收集气体 | |
| D. | CuO(C)--直接在空气中加热 |
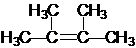 ;
;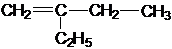 .
.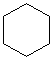 .
.