题目内容
【题目】乙苯是重要的化工原料,有关乙苯的转化关系如图所示。已知
CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
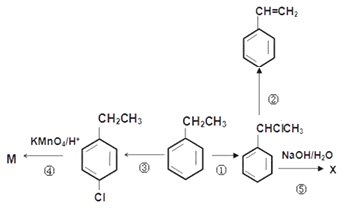
请回答下列问题:
(1)写出下列反应进行时的试剂与条件:反应②______________,反应③______________;
(2)写出下列反应的类型:反应①______________,④反应______________;
(3)写出下列物质的结构简式:M____________________
(4)②反应后的有机产物最多有多少碳原子共面______________
(5)写出下列反应的化学方程式:反应⑤________________________________________________;
【答案】氢氧化钠醇(乙醇)溶液、加热 Cl2、(Fe)FeCl3催化剂 取代反应 氧化反应 ![]() 8
8 ![]() +NaOH
+NaOH![]()
![]() +NaCl
+NaCl
【解析】
反应①为 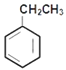 +Cl2
+Cl2 ![]()
![]() +HCl;反应②为
+HCl;反应②为![]() →
→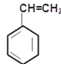 ,结合题中已知可知,发生类似CH3CH2Br+NaOH
,结合题中已知可知,发生类似CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O的反应;反应③为
CH2=CH2+NaBr+H2O的反应;反应③为 +Cl2
+Cl2 ![]()
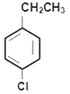 +HCl;反应④为
+HCl;反应④为 被酸性高锰酸钾氧化成
被酸性高锰酸钾氧化成![]() ,为氧化反应;反应⑤发生类似CH3CH2Br+NaOH
,为氧化反应;反应⑤发生类似CH3CH2Br+NaOH![]() CH3CH2OH+NaBr的反应,故X的结构简式为
CH3CH2OH+NaBr的反应,故X的结构简式为![]() 。
。
(1)反应②为![]() →
→ ,反应的条件为氢氧化钠醇(乙醇)溶液、加热;反应③为
,反应的条件为氢氧化钠醇(乙醇)溶液、加热;反应③为 +Cl2
+Cl2 ![]()
 +HCl,反应的条件为Cl2、(Fe)FeCl3催化剂;
+HCl,反应的条件为Cl2、(Fe)FeCl3催化剂;
(2)反应①为取代反应,反应④为氧化反应;
(3)根据分析,M的结构式为![]() ;
;
(4)由苯分子、乙烯分子等结构共面可知 中所有的碳原子都可以共面,所以最多有8个碳原子共面;
中所有的碳原子都可以共面,所以最多有8个碳原子共面;
(5)反应⑤的化学方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl。
+NaCl。

【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:

①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。

用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
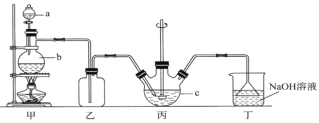
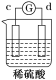
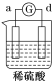
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c