题目内容
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理后的排放情况。
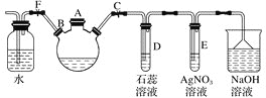
I、实验室通过如图所用的装置制备Na2S2O3
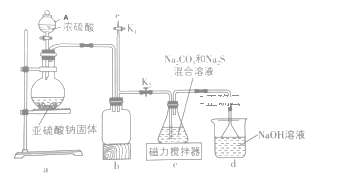
(1)仪器A的名称___,使用前注意的事项___。
(2)b装置的作用是___。
(3)装置a中发生反应的化学方程式____。
(4)反应开始后,c中先有淡黄色浑浊产生,此浑浊物为___(填化学式);反应后剩余的SO2全部被d中的氢氧化钠溶液吸收,若恰好生成酸式盐,反应后的溶液呈___(“酸”或“碱”)性,原因是___。
II、已知:废水中氰化钠的最高排放标准为0.50mg/L。
(1)向氰化钠溶液中通入少量CO2能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序(用序号表示):___。
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN与NaClO反应,生成NaOCN和NaCl;第二步,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。某工厂含氰废水中NaCN的含量为1.47mg/L,处理10m3这样的废水,理论上需要5mol/LNaClO溶液___L处理后才可以进行排放。
【答案】分液漏斗 检验是否漏液 作安全瓶,防止倒吸 Na2SO3+H2SO4=Na2SO3+SO2↑+H2O S 酸 HSO3-的电离大于水解 ②①③ 0.15
【解析】
I、(1)仪器A的名称是分液漏斗;分液漏斗使用前需要注意检查是否漏液,避免发生实验安全事故;
(2)根据装置图和气体压强变化,装置b能作安全瓶,防止倒吸;
(3)a装置制备二氧化硫,其反应方程式为:Na2SO3+H2SO4=Na2SO3+SO2↑+H2O;
(4)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3,c中先有浑浊产生,后又变澄清,此浑浊物为S;该酸式盐为NaHSO3,因HSO3-的电离大于水解,因此溶液呈酸性;
II、(1)根据强酸制弱酸的规律可知,酸性由大到小顺序为:H2CO3>HCN>HCO3-,根据越弱越水解,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序为:②①③;
(2)根据第一步和第二步的总反应可知,整个反应中氧化剂为NaClO,还原剂为NaCN,C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,根据得失电子守恒可列出关系式:
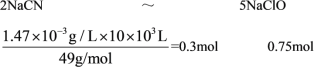
理论上需要5mol/LNaClO溶液为![]() =0.15L。
=0.15L。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案