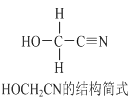
题目内容
【题目】NH3及其盐都是重要的化工原料。
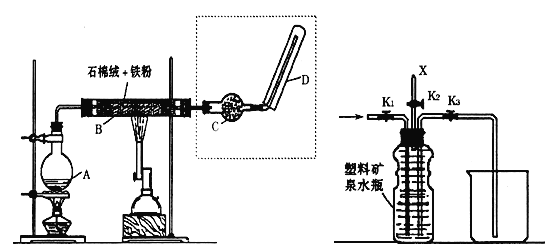
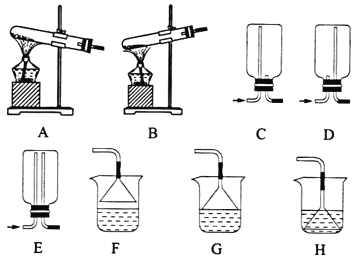
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为__。
(2)按如图装置进行NH3性质实验。
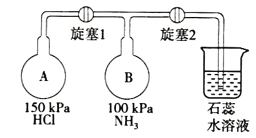
①先打开旋塞1,B瓶中的现象是___,原因是___,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是____。
【答案】A、C、G 有白烟生成 A瓶中的氯化氢移动到B瓶中,与B瓶中的氨气反应生成氯化铵,能看到白烟 液体进入B瓶中,溶液的颜色变红
【解析】
(1)实验室用加热固体氯化铵和熟石灰制取氨气,反应发生为固体与固体加热制取气体的装置,根据氨气为易溶于水密度比空气小的气体性质选择收集装置,氨气极易溶于水,尾气处理需考虑倒吸;
(2)由于A中压强比B中大,所以当打开旋塞1时,A中的HCl会进入B中与NH3反应生成氯化铵,产生大量的白烟,稳定后,再打开旋塞2,由于氯化氢和氮气反应生成了固体氯化铵,导致烧瓶内的压强减小,使烧杯中的石蕊溶液进入B瓶。
(1)实验室用加热固体氯化铵和熟石灰制取氨气,反应发生为固体与固体加热制取气体的装置,应选择装置A制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向下排空气法收集,应选择装置C收集氨气,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗边缘浸入水中能防止倒吸,应选装置G进行尾气处理,故答案为:ACG;
(2)①由于A中压强比B中大,所以当打开旋塞1时,A中的HCl会进入B中与NH3反应生成氯化铵,产生大量的白烟,故答案为:有白烟生成;A瓶中的氯化氢移动到B瓶中,与B瓶中的氨气反应生成氯化铵,能看到白烟;
②稳定后,再打开旋塞2,由于氯化氢和氨气反应生成了固体氯化铵,导致烧瓶内的压强减小,使烧杯中的石蕊溶液进入B瓶,氯化铵溶液呈酸性,溶液变为红色,故答案为:液体进入B瓶中,溶液的颜色变红。

【题目】在一定温度下,10mL 0.40mol/L H2O2 溶液发生催化分解。不同时刻测得生成![]() 的体积(已折算为标准状况)如下表。
的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6min的平均反应速率:v(H2O2)=3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C. 反应到6min时,c(H2O2)=0.30mol/L
D. 反应到6min时,H2O2 分解了50%
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J | ||||
R |
(1)M的离子结构示意图为__________;元素T在周期表中位于第________族。
(2)J元素名称是______,他和氢组成10电子的化合物,其分子式为______________,属___________(填“离子化合物”或“共价化合物”)。
(3)R元素符号为_______,其最高能层符号是________。