题目内容
常温下,0.1mol?L-1 NH4HCO3溶液的pH=7.8,该溶液中微粒浓度间关系正确的是( )
| A、c(OH-)>c(H+) |
| B、c(HCO3-)>c(NH4+) |
| C、c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、c(H2CO3)+c(H+)=c(CO32-)+2c(NH3?H2O)+c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:常温下,0.1mol?L-1 NH4HCO3溶液的pH=7.8,说明NH4+水解程度小于HCO3-水解程度,导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答:
解:A.常温下溶液的pH=7.8>7,说明溶液呈碱性,则c(OH-)>c(H+),故A正确;
B.常温下,0.1mol?L-1 NH4HCO3溶液的pH=7.8,说明NH4+水解程度小于HCO3-水解程度,所以c(HCO3-)<c(NH4+),故B错误;
C.溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C正确;
D.根据电荷守恒得c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(NH4+)+c(NH3?H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(H2CO3)+c(H+)=c(CO32-)+c(NH3?H2O)+c(OH-),故D错误;
故选AC.
B.常温下,0.1mol?L-1 NH4HCO3溶液的pH=7.8,说明NH4+水解程度小于HCO3-水解程度,所以c(HCO3-)<c(NH4+),故B错误;
C.溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C正确;
D.根据电荷守恒得c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(NH4+)+c(NH3?H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(H2CO3)+c(H+)=c(CO32-)+c(NH3?H2O)+c(OH-),故D错误;
故选AC.
点评:本题考查了离子浓度大小比较,根据溶液酸碱性确定水解程度,再结合守恒思想分析解答,注意D选项,为易错点.

练习册系列答案
相关题目
下列化学方程式错误的是( )
| A、氯气通入冷的消石灰中 2Cl2+Ca(OH)2═Ca(ClO)2+CaCl2+2H2O |
| B、二氧化氮气体通入氢氧化钠溶液 2NO2+2NaOH═2NaNO3+H2O |
| C、向硫酸铝溶液中滴入氨水 Al2(SO4)3+6NH3?H2O═2Al(OH)3↓+3(NH4)2SO4 |
| D、氧化铝溶解于氢氧化钠溶液 Al2O3+2NaOH═2NaAlO2+H2O |
下列物质均易溶于水,但其纯物质分子间不能形成氢键的是( )
| A、HCHO |
| B、CH3OH |
| C、CH3COOH |
| D、HF |
下列几组判断均正确的是( )
①
H和
H互为同位素
②O2和O3互为同素异形体
③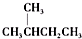 和
和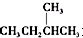 为同分异构体
为同分异构体
④ 和
和 为同一物质
为同一物质
⑤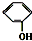 和
和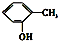 为同系物
为同系物
⑥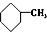 和
和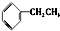 为芳香化合物.
为芳香化合物.
①
1 1 |
2 1 |
②O2和O3互为同素异形体
③
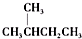 和
和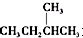 为同分异构体
为同分异构体④
 和
和 为同一物质
为同一物质⑤
 和
和 为同系物
为同系物⑥
 和
和 为芳香化合物.
为芳香化合物.| A、①②④⑤ | B、①③④⑥ |
| C、①②⑤⑥ | D、②③④⑤ |
分子式为C4H7O2Br的有机物能与碳酸氢钠溶液反应产生气体,该有机物的结构可能有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
分子式为C4H9Cl 的同分异构体共有(不考虑立体异构)( )
| A、4 | B、5 | C、6 | D、7 |
MnO2和Zn是制造普通干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)来制取:
①将软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O;
②除去反应混合物中的不溶物;
③电解混合物:MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4
下列说法错误的是( )
①将软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O;
②除去反应混合物中的不溶物;
③电解混合物:MnSO4+ZnSO4+2H2O
| ||
下列说法错误的是( )
| A、干电池是一种将化学能转变为电能的装置 |
| B、步骤③电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+ |
| C、步骤①每析出12.8g S沉淀,共转移0.8mol电子 |
| D、步骤③的反应也可以设计成原电池 |
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A、硫酸铜溶液 | B、泥水 |
| C、葡萄糖注射液 | D、树林中的雾 |
把镁带投入盛有盐酸的敞口容器里,下列因素对反应速率有影响的是( )
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度.
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度.
| A、①② | B、③④ |
| C、①②③④ | D、①②③ |