题目内容
【题目】荧光材料硫化锌(ZnS)的研究至今已有 150 多年的历史,可用于制白色颜料、发光粉、发光油漆等,其久置于湿空气中易被氧化为 ZnSO4。请回答下列问题:
(1)基态 Zn 原子的电子排布式为_________________________,核外电子占据最高能层的符号是__________________________, 占据该能层电子的电子云轮廓图形状为__________________________。
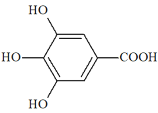
(2)ZnSO4 中三种元素的电负性由大到小的顺序为__________________________,![]() 的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
(3)ZnSO4 溶于氨水可生成[Zn(NH3)4]SO4 溶液,[Zn(NH3)4]SO4 溶液中不存在的微粒间作用力有__________________________。
A.离子键B.共价键C.配位键D.范德华力
(4)根据下列锌卤化物的熔点和溶解性,判断 ZnF2 晶体的类型为______;分析 ZnCl2、ZnBr2、ZnI2 熔点依次增大的原因__________________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中的溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5) 立方 ZnS 晶体的密度为 ρ g/cm3,其晶胞结构如图。

S2-周围等距离且最近的 Zn2+为__________________________;ZnS晶胞中的晶胞参数 a=__________________________nm(列出计算式)。[ M(ZnS)=97 g/mol ]
【答案】1s22s22p63s23p63d104s2或[Ar]3d104s2 N 球形 O>S>Zn 正四面体 sp3杂化 A
离子晶体 ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔点依次增大 4 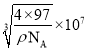
【解析】
根据原子核外电子排布规律书写Zn原子的核外电子排布式,根据元素周期律判断电负性大小,根据杂化轨道与价电子互斥理论判断粒子空间构型及杂化轨道类型,根据物理性质判断晶体类型,结合粒子间的作用力对熔沸点的影响进行分析,根据均摊法和立体几何知识进行晶胞的相关计算。
(1)Zn的核电荷数为30,基态Zn原子的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,其核外电子占据最高能层的符号是N,占据该能层电子的为4s轨道,其电子云轮廓图形状为球形,故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;N;球形;
(2)ZnSO4中三种元素为Zn、O、S,非金属性的强弱顺序为O>S,Zn为金属元素,则电负性由大到小的顺序为O>S>Zn,硫酸根中中心原子的孤电子对数为![]() =0,成键电子对数为4,价层电子对数为4,所以立体构型为正四面体结构,中心原子S为sp3杂化,故答案为:O>S>Zn;正四面体;sp3杂化;
=0,成键电子对数为4,价层电子对数为4,所以立体构型为正四面体结构,中心原子S为sp3杂化,故答案为:O>S>Zn;正四面体;sp3杂化;
(3)[Zn(NH3)4]SO4中存在离子键、共价键、配位键,不存在范德华力,而[Zn(NH3)4]SO4在溶液中以离子形式存在,离子键不存在,溶剂H2O中存在共价键、水分子间存在范德华力,故答案为:A;
(4)根据表格信息可知,ZnF2晶体的熔点比ZnCl2、ZnBr2、ZnI2高,且不溶于乙醇、乙醚等有机溶剂,可判断晶体类型为离子晶体;ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔点依次增大,故答案为:离子晶体;ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔点依次增大;
(5)由晶胞结构图可知,在ZnS晶胞结构中S2-周围等距离且最近的Zn2+为4,Zn2+位于晶胞的顶点和面心,S2-位于晶胞体内,则一个晶胞中Zn2+的个数为![]() ,S2-的个数为4,所以一个晶胞中含有4个ZnS,其物质的量为
,S2-的个数为4,所以一个晶胞中含有4个ZnS,其物质的量为![]() ,质量
,质量![]() ,该晶胞的密度为ρ g/cm3,则晶胞的体积
,该晶胞的密度为ρ g/cm3,则晶胞的体积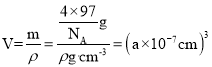 ,因此晶胞参数
,因此晶胞参数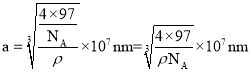 ,故答案为:4;
,故答案为:4;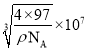 。
。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
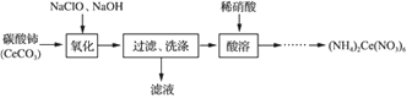
新编小学单元自测题系列答案【题目】(NH4)2Fe(SO4)2·6H2O俗称摩尔盐(M=392g·mol-1)是分析化学中重要的标准物质,某研究小组拟采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)为原料制取摩尔盐,设计了如下流程:
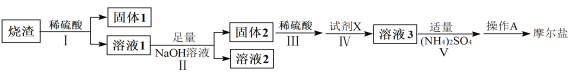
(1)写出试剂X的化学式__________。
(2)写出“溶液1”中某种离子与NaOH反应生成“溶液2”中离子的离子方程式________。
(3)操作A为蒸发浓缩至_________、冷却结晶、过滤、洗涤、干燥。其中过滤操作可用如图装置进行,请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→_________→d→c→关抽气泵。
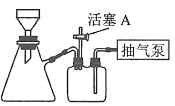
a.转移固液混合物
b.关活塞A
c.开活塞A
d.确认抽干
e.加洗涤剂洗涤
(4)实验制得的摩尔盐的纯度可用Ce(SO4)2标准溶液滴定进行测定。滴定反应为Fe2++Ce4+=Fe3++Ce3+。测定时,先称取4.000g样品,配成100mL溶液,取出其中20.00mL放入锥形瓶中,对溶液进行必要处理后,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
滴定次数 | 0.1000mol·L-1Ce(SO4)2标准溶液体积(mL) | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 20.12 |
2 | 0.12 | 20.10 |
3 | 0.05 | 21.65 |
①产品中摩尔盐的纯度为__________(用质量分数表示,保留4位有效数字)。
②若滴定过程中没有润洗滴定管,则会造成样品纯度______(填“偏高”、“偏低”或“无影响”)