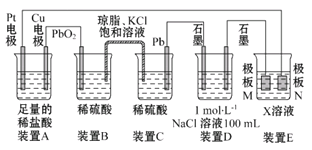
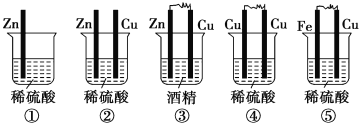
题目内容
【题目】0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。
(1)写出反应的热化学方程式。
(2)已知H2O(l)转化为H2O(g)的△H=44kJ·mol-1,试计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量。
【答案】B2H6(g)+3O2(g)====B2O3(s)+3H2O(l) ΔH="-2" 165 kJ·mol-11 016.5
【解析】
试题(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ/mol。
(2)①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
②H2O(l)═H2O(g)△H=+44kJ/moL,
由盖斯定律可知①+②![]() 3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量2033kJ×0.5=1016.5kJ,

【题目】(1)已知25℃:
H2S | 一元酸HA |
Ka1=9.1×10—8,Ka2=1.1×10—12, | Ka=9.1×10—10 |
写出H2S与钾盐KA溶液 ( A-表示酸根 ) 反应的化学方程式:______________________。
(2)次磷酸(H3PO2)是一种化工产品,具有较强的还原性。
①H3PO2是一元弱酸,写出其电离方程式____________________ 。
②H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。NaH2PO2为________(填 “正盐”或“酸式盐”),其溶液显______(填“弱酸性”、“中性”或“弱碱性”)。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_______(填化学式)。
(3)向NH4Al(SO4)2溶液中滴加1molL—1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化如图所示。(滴加过程无气体放出)
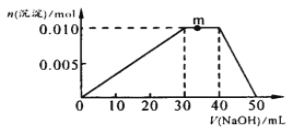
①写出m点发生反应的离子方程式_____________________________________。
②往NH4Al(SO4)2溶液中改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_____________mol 。