题目内容
【题目】认真观察下列装置,回答下列问题:
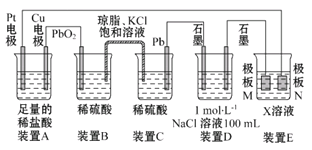
(1)装置B中PbO2上发生的电极反应为____________________________。
(2)装置A中总反应的离子方程式为______________________________。
(3)若装置E的目的是在铜上镀银,则X为____,极板N的材料为____。
(4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____(标准状况)。
【答案】PbO2+4H++SO42-+2e-=PbSO4+2H2OCu+2H+![]() Cu2++H2↑硝酸银溶液银3.92L
Cu2++H2↑硝酸银溶液银3.92L
【解析】
(1)根据装置图可知,BC是原电池,二氧化铅是正极,得到电子,电极反应式为 PbO2+4H++SO42-+2e-=PbSO4+2H2O,故答案为:PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)A中铜电极和正极相连,是阳极,铜失去电子。阴极是Pt,溶液中的氢离子得到电子,所以总的反应式为Cu+2H+![]() Cu2++H2↑,故答案为:Cu+2H+
Cu2++H2↑,故答案为:Cu+2H+![]() Cu2++H2↑;
Cu2++H2↑;
(3)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以X是硝酸银溶液,N是阳极,则N是银,故答案为:硝酸银溶液;银;
(4)当装置A中Cu电极质量改变6.4g时,转移电子是6.4g÷64g/mol×2=0.2mol。装置D中氯化钠是0.1mol,阴极是氢离子放电,电极反应式为:2H++2e-===H2↑,则产生氢气是0.1mol。阳极是氯离子放电,电极反应式为:2Cl—2e-=Cl2↑,氯离子只有0.1mol,故当转移电子0.1mol时,氯离子放电完毕,所以阳极还有氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2,由电极反应式可得生成氯气为0.05mol、生成氧气为0.1mol÷4=0.025mol,所以标准状况下的体积共计是(0.1mol+0.05mol+0.025mol)×22.4L/mol=3.92L,故答案为:3.92L。

【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D





