��Ŀ����
����Ŀ��������CO2����ƫ���������ЧӦ��Ҳ������彡�����Ӱ�죻CO2����;�㷺������ʹ����ɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
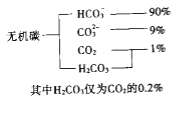
��1��һ��������CO2���Ƶ�Na2CO3��NaHCO3�ȡ�
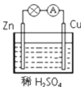
�������ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ������ǰ��____���ߣ�����>����<������=������
���������������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L�ĵ������Һ������ϡ����ͬ����ʱ������pH�仯������__������ĸ��ţ���
A��Na2CO3 |
B��NaHCO3 |
C��NaAlO2 |
D��CH3COONa |
E��NaOH
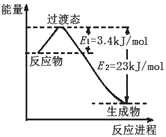
��2����֪��ӦFe(s)��CO2(g)![]() FeO(s)��CO(g) ��H��a kJ/mol������ڲ�ͬ�¶��£�
FeO(s)��CO(g) ��H��a kJ/mol������ڲ�ͬ�¶��£�
�÷�Ӧ��ƽ�ⳣ��K���¶ȵı仯���£�
�¶�(��) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
������Ӧ��a_______0������>������<������=��)����2L�ܱ�������300���½��з�Ӧ����Fe��CO2����ʼ����Ϊ4 mol�����ﵽƽ��ʱCO2��ת����Ϊ________��
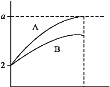
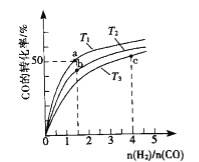
��3��Ŀǰ��ҵ�Ͽ�����CO2��H2��230�������������·�Ӧ���ɼ״�������ˮ��������ͼΪ��ѹ������0.5 mol CO2��1.5 mol H2��Ӧת���ʴ�80%ʱ�������仯ʾ��ͼ����÷�Ӧ���Ȼ�ѧ����ʽΪ__________��
��4���˹���������ܹ�����̫���ܣ���CO2��H2O�Ʊ���ѧԭ�ϡ���ͼ���Ʊ�HCOOH��ʾ��ͼ������Ҫ��ش����⣺
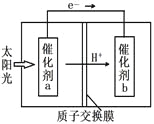
������b����ĵ缫��ӦʽΪ__________��
�����ⶨ����ÿ����ͨ�����ӽ���Ĥ��H+�����ʵ���Ϊ40mol����ÿСʱ�ɲ���O2_____kg��
���𰸡�> E > 75% CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H =��49 kJ/mol CO2+2e��+2H+=HCOOH 19.2
CH3OH(g)+H2O(g) ��H =��49 kJ/mol CO2+2e��+2H+=HCOOH 19.2
��������
��1���������ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ��Na2CO3��ˮ��̶ȸ���Na2CO3��Һ�ļ��Խ�ǿ���ʼ���ǰ��>���ߣ�
��Na2CO3 ��NaHCO3��NaAlO2 ��CH3COONa����ǿ�������Σ�ϡ��ʱ��ٽ�ˮ�⣬������Һ�ļ��Ա仯��С��NaOH��ȫ���룬ϡ��ʱ���Ա仯���ѡE��
��2���ӱ��п����������¶ȵ�����ƽ�ⳣ�����������¶�ƽ��������Ӧ�����ƶ���������Ӧ���������ȷ�Ӧ����a>0��Fe��CO2����ʼ����Ϊ4 mol����CO2����ʵŨ��Ϊ2mol/L����CO2��Ӧ��x mol/L�����ݷ�Ӧ����ʽ�����У�
Fe(s)��CO2(g)![]() FeO(s)��CO(g)
FeO(s)��CO(g)
c����ʼ��mol/L 2 0
c���仯��mol/L x x
c��ƽ�⣩mol/L 2-x x
K=c(CO)/ c(CO2)= x/(2-x)=3���ã�x=1.5 mol/L��CO2��ת����Ϊ��1.5 mol��L/2 mol/L=0.75 =75%��
��3����ͼ������Ӧ�������������������������ʷ�Ӧ�Ƿ��ȷ�Ӧ���ٸ��������ı仯ͼ��֪��0.5 mol CO2��1.5 mol H2��Ӧת���ʴ�80%ʱ����Ϊ��19.6 kJ����ô1mol CO2��3mol H2��Ӧ�ų�����Ϊ49kJ�����Ȼ�ѧ����ʽΪ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H =��49 kJ/mol��
CH3OH(g)+H2O(g) ��H =��49 kJ/mol��
��4�������ݵ��ӵ��ƶ�����֪��b������������������ԭ��Ӧ��Ԫ�صĻ��ϼ۽��ͣ�CO2��������Ӧ����HCOOH���缫��ӦΪ��CO2+2e��+2H+=HCOOH��
������2O2-��O2��ת�Ƶĵ���Ϊ4e-����ÿ����ͨ�����ӽ���Ĥ��H+�����ʵ���Ϊ40mol����ôת�Ƶĵ���ҲΪ40mol���������O2�����ʵ���Ϊ10mol��һСʱ��������600mol������Ϊ��600mol��32g/mol=19200g= 19.2 kg��

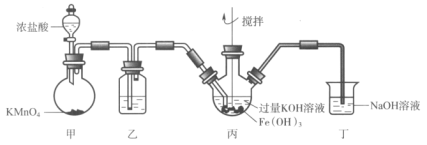
����Ŀ������a��b��c��ʾ��Ӧ�����м�����Լ���������ͼ��ʾװ����ȡ���������ռ���������(����)
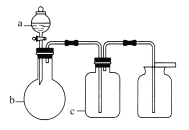
ѡ�� | ���� | a | b | c |
A | NH3 | Ũ��ˮ | ��ʯ�� | ��ʯ�� |
B | SO2 | 70%��ŨH2SO4 | Na2SO3���� | 98%��ŨH2SO4 |
C | NO | ϡHNO3 | ͭм | H2O |
D | NO2 | ŨHNO3 | ͭм | NaOH��Һ |
A.AB.BC.CD.D