题目内容
X、Y、Z、W四种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为17.其中W的阴离子核外电子数与Z原子的最内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Y、Z均能形成双原子分子.根据以上叙述,下列说法中正确的是( )
| A、以上四种元素的原子半径大小为X<Y<Z<W |
| B、X2W2、W2Y、WZ均为直线型的共价化合物 |
| C、W与Y形成的化合物W2Y2在化学反应中既可作氧化剂也可作还原剂 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X的一种核素在考古时常用来鉴定一些文物的年代,X应为C元素,工业上采用液态空气分馏方法来生产Y的单质,则Y可能为N或O元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为17,如Y为N,则Z的最外层电子数为17-4-5=8,应为He,不能形成双原子分子,与Y为O元素,则Z的最外层电子数为17-4-6=7,为F元素,W的阴离子核外电子数与Z原子的最内层电子数相同,W应为H元素,阴离子有2个电子,结合元素周期律的递变规律解答该题.
解答:
解:X的一种核素在考古时常用来鉴定一些文物的年代,X应为C元素,工业上采用液态空气分馏方法来生产Y的单质,则Y可能为N或O元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为17,如Y为N,则Z的最外层电子数为17-4-5=8,应为He,不能形成双原子分子,与Y为O元素,则Z的最外层电子数为17-4-6=7,为F元素,W的阴离子核外电子数与Z原子的最内层电子数相同,W应为H元素,
A.同周期元素原子半径从左到右逐渐减小,应为C>O>F>H,故A错误;
B.H2O为V形结构,故B错误;
C.W与Y形成的化合物H2O2中,O元素化合价为-1价,为中间价态,既可作氧化剂也可作还原剂,故C正确;
D.由W与X组成的化合物如相对分子质量角度,在常温下为固体时,则沸点肯定大于水,故D错误.
故选C.
A.同周期元素原子半径从左到右逐渐减小,应为C>O>F>H,故A错误;
B.H2O为V形结构,故B错误;
C.W与Y形成的化合物H2O2中,O元素化合价为-1价,为中间价态,既可作氧化剂也可作还原剂,故C正确;
D.由W与X组成的化合物如相对分子质量角度,在常温下为固体时,则沸点肯定大于水,故D错误.
故选C.
点评:本题考查原子结构与元素周期律的关系,题目难度中等,本题注意正确推断元素的种类为解答该题的关键,易错点为D,注意碳氢化合物的种类以及性质.

练习册系列答案
相关题目
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )
| A、CH4?14H2O | ||
| B、CH4?8H2O | ||
C、CH4?
| ||
| D、CH4?6H2O |
下列反应中,通过置换反应得到铁的是( )
| A、铜浸入氯化铁溶液中 |
| B、一氧化碳通过炽热的氧化铁 |
| C、铝和Fe2O3混合物加热至高温 |
| D、铜浸入氯化亚铁溶液中 |
下列四种溶液中一定存在SO42-的是( )
| A、向甲溶液中加入BaCl2溶液,产生白色沉淀 |
| B、向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解 |
| C、向丙溶液中加入盐酸使之酸化无现象,再加入BaCl2溶液,有白色沉淀 |
| D、向丁溶液中加入硝酸使之酸化,再加入硝酸钡溶液,有白色沉淀 |
设NA为阿伏伽德罗常数,下列有关叙述中正确的是( )
| A、标准状况下,2.24L Cl2完全溶于水,反应中转移的电子数为0.1NA |
| B、标准状况下,1.12L CCl4中含有的C-Cl键的数目大于0.2NA |
| C、某密闭容器中装有23g NO2气体,则含有的原子数小于1.5NA |
| D、58.5g的氯化钠固体中含氯化钠分子数为NA |
将3.6g炭粉跟Fe3O480%的磁铁矿粉29g混合后,隔绝空气加强热,反应后收集到的气体恢复到标准状况时,其体积为6.72升,则气体是( )
| A、全部是CO2 | ||
| B、CO和CO2各占一半 | ||
| C、全部是CO | ||
D、CO和CO2的混合物,其中CO体积占
|
新弹性材料丁基苯呲橡胶的结构简式如图.

其单体可能是以下物质中的某几种正确的一组单体是( )
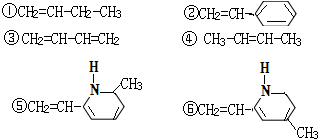

其单体可能是以下物质中的某几种正确的一组单体是( )

| A、①②⑥ | B、②③⑤ |
| C、①②⑤ | D、②④⑥ |
下列有关物质的性质、应用或制取的说法正确的是( )
| A、工业上将氯气通入澄清石灰水中,制取漂白粉 |
| B、除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤 |
| C、自来水厂可用明矾对水进行消毒杀菌 |
| D、常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 |
下列过程都与热量变化有关,其中表述正确的是( )
A、CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+
| ||
| B、已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 | ||
| C、铝热反应是放热反应,但需要足够的热量才能使反应发生 | ||
| D、水的电离过程是吸热过程,升高温度,水的离子积增大、pH增大 |