题目内容
【题目】大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“苏氏三兄弟”,它们在生活、生产中有广泛应用。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式___,操作时,往饱和食盐水中先通入气体,先制备小苏打的原因是___。
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因__。
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是__。
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式__。Na2S溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式为__。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时![]() 满足的条件是__。
满足的条件是__。
【答案】NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl NaHCO3溶解度比Na2CO3小,易分离出来 S2O32-+2H+=S↓+SO2↑+H2O 将CaSO4转化成CaCO3 Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2 Na2S2 ≥2
【解析】
(1)NaHCO3溶解度比Na2CO3小,易分离出来;
(2)酸性环境下S2O32-发生歧化反应,消耗的硫代硫酸根钠偏多,测定结果会偏高;
(3)将硫酸钙转化为易除的碳酸钙;
(4)依据题干可知Na2CO3和Na2S以1:2的物质的量之比混合,再通入二氧化硫发生反应生成Na2S2O3和二氧化碳,依据原子个数守恒、得失电子守恒书写方程式;依据过氧化钠结构结合氧原子、硫原子结构解答;
(5)Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3![]() Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,由此分析解答。
Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,由此分析解答。
(1)NaHCO3溶解度比Na2CO3小,易分离出来,往饱和食盐水中先通入气体,制备小苏打的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(2)酸性环境下S2O32-发生歧化反应,离子方程式:S2O32-+2H+=S↓+H2O+SO2↑;
(3)先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是将硫酸钙转化为易除的碳酸钙,发生的离子反应方程式为:CaSO4+CO32-=CaCO3+SO42-;
(4)依据题干可知Na2CO3和Na2S以1:2的物质的量之比混合,再通入二氧化硫发生反应生成Na2S2O3和二氧化碳,反应中S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,依据原子个数守恒、得失电子守恒反应的方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;Na2S溶液在空气中长期放置,和氧气反应生成与过氧化钠的结构及化学性质相似的物质Na2S2;
(5)Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3![]() Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,则n(NaHCO3):n(Na2O2)≥2。
Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,残留固体为纯净物,则为碳酸钠,则n(NaHCO3):n(Na2O2)≥2。

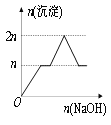
【题目】含MgCl2、AlCl3均为nmol的混合液,向其中滴加NaOH溶液至过量。有关离子沉淀或沉淀溶解与pH的关系如下表。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是( )
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀pH | 8.93 | 3.56 | 开始溶解pH | 8.04 |
完全沉淀pH | 10.92 | 4.89 | 完全溶解pH | 12.04 |
A. B.
B.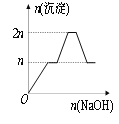
C.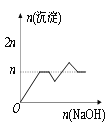 D.
D.