题目内容
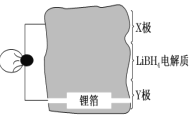
【题目】(1)全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2=Mg+2LiH。放电时,X 极作_________极。充电时,Y 极反应式为___________。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
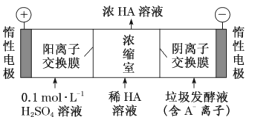
①阳极的电极反应式为 ________________
②简述浓缩室中得到浓乳酸的原理:________________
③电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 gL 1 乳酸溶液通电一段时间后,浓度上升为 145 gL 1 (溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____________L。(乳酸的摩尔质量为90 gmol-1)
【答案】正 LiH + e- = Li +H- 4OH- 4e- = O2↑+ 2H2O 阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA 6.72
【解析】
⑴放电时电池反应为 2Li+MgH2 = Mg+2LiH。Li化合价升高失去电子,放电时,作负极,MgH2作正极;
⑵①阳极上阴离子得到电子,即水中的氢氧根得到电子;②阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA;③计算乳酸增加的质量,再计算乳酸的物质的量,根据2HA —2A-—H2关系得到阴极上产生的H2的物质的量及体积。
⑴全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2 = Mg+2LiH。Li化合价升高失去电子,放电时,作负极,MgH2作正极,因此放电时,X极作正极,充电时,Y极为阴极,其电极反应式为LiH + e- = Li +H-,故答案为:正;LiH + e- = Li +H-;
⑵①阳极上阴离子得到电子,即水中的氢氧根得到电子,其电极反应式为4OH- 4e- = O2↑+ 2H2O,故答案为:4OH- 4e- = O2↑+ 2H2O;
②简述浓缩室中得到浓乳酸的原理:阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA,故答案为:阳极室中的H+穿过阳离子交换膜与阴极室中穿过阴离子交换膜的A-离子在浓缩室结合生成HA;
③400 mL 10 gL 1 乳酸溶液通电一段时间后,浓度上升为 145 gL 1 (溶液体积变化忽略不计),则增加的乳酸的质量为(145 gL 110 gL 1)×0.4L=54g,增加的乳酸的物质的量为![]() ,根据2HA —2A-—H2关系得到阴极上产生的 H2的物质的量为
,根据2HA —2A-—H2关系得到阴极上产生的 H2的物质的量为![]() ,在标准状况下的体积约为0.3mol×22.4 Lmol 1 = 6.72L,故答案为:6.72。
,在标准状况下的体积约为0.3mol×22.4 Lmol 1 = 6.72L,故答案为:6.72。