题目内容
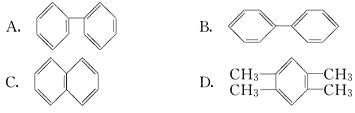
【题目】含MgCl2、AlCl3均为nmol的混合液,向其中滴加NaOH溶液至过量。有关离子沉淀或沉淀溶解与pH的关系如下表。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是( )
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀pH | 8.93 | 3.56 | 开始溶解pH | 8.04 |
完全沉淀pH | 10.92 | 4.89 | 完全溶解pH | 12.04 |
A. B.
B.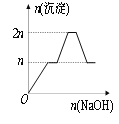
C.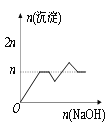 D.
D.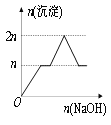
【答案】C
【解析】
根据开始沉淀时的pH可知,当Al3+完全沉淀时,Mg2+还没有开始沉淀;而当Mg2+开始沉淀时,已经有部分氢氧化铝开始溶解;而当Mg2+完全沉淀时,氢氧化铝还没有完全被溶解。
当Al3+完全沉淀时,溶液的pH=8.04,而镁离子开始沉淀的pH=8.93,则Al3+完全沉淀时Mg2+还没有开始沉淀;即当Mg2+开始沉淀时,已经有部分氢氧化铝开始溶解;镁离子完全沉淀的pH=10.92,氢氧化铝完全溶解的pH=12.04,则当Mg2+完全沉淀时,氢氧化铝还没有完全被溶解,所以正确的图象应该是C。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如表:
物质 | H2 | CO | CH3OH |
浓度/(mol/L) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10 min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=_______ mol/(L·min);
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是_______(选填序号);
a.2v逆(CO) = v正(H2)
b.c(CO): c(H2):c(CH3OH) =1:2:1
c.混合气体的平均式量保持不变
d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是_______(选填序号);
a.其他条件不变,增大压强,平衡常数K﹤160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由____。