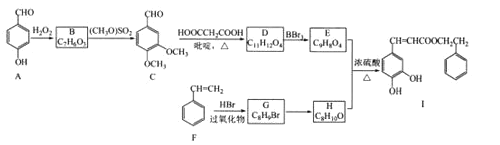
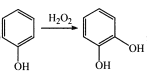
题目内容
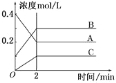
【题目】常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
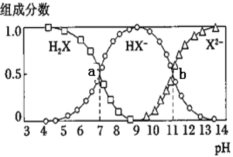
A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2OHX-+OH-的平衡常数对数值1gK=-11
【答案】C
【解析】
在H2X溶液中滴加NaOH溶液首先发生反应![]() ,该反应过程中H2X的浓度逐渐减小,HX-的浓度逐渐增大;然后发生
,该反应过程中H2X的浓度逐渐减小,HX-的浓度逐渐增大;然后发生![]() ,HX-的浓度逐渐减小,X2-的浓度逐渐增大,根据反应过程及每个阶段中粒子种类的变化分析。
,HX-的浓度逐渐减小,X2-的浓度逐渐增大,根据反应过程及每个阶段中粒子种类的变化分析。
A.由图像可知a点的溶质组成为H2X和NaHX的混合溶液,b点为NaHX和Na2X的混合溶液,H2X是酸抑制水的电离,Na2X为强碱弱酸盐促进水的电离,由此可知b点水的电离程度大于a点水的电离程度,故A错误;
B.由图像可知,当溶液中HX-和X2-的浓度相等时,溶液的pH值等于11,但等物质的量的NaHX、Na2X溶于水中,X2-的水解程度大于HX-的水解程度,因此溶液中的HX-的浓度大于X2-的浓度,溶液pH值略小于11,故B错误;
C.由a点可求![]() ,
,![]() ;.由b点可求
;.由b点可求![]() ,
,![]() ,常温下的Ka(HY)=1.1×10-10,则酸性
,常温下的Ka(HY)=1.1×10-10,则酸性![]() ,根据强酸制弱酸的原理则少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-,故C正确;
,根据强酸制弱酸的原理则少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-,故C正确;
D. 反应X2-+H2OHX-+OH-的平衡常数![]() =
=![]() ,1gK=-3,故D错误;
,1gK=-3,故D错误;
故选:C。

 阅读快车系列答案
阅读快车系列答案【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
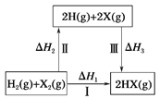
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
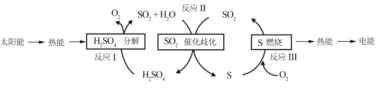
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
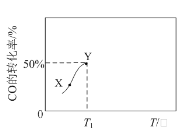
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
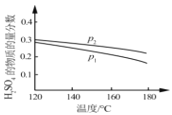
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。