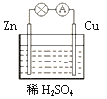
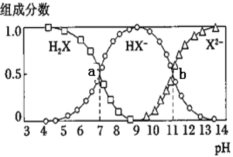
题目内容
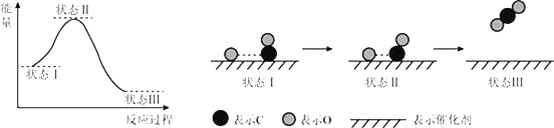
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( )
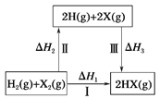
A.![]() △H3<0
△H3<0
B.反应热与反应的途径无关,所以![]()
C.![]() 键、
键、![]() 键、
键、![]() 键键能依次减小,所以途径Ⅱ吸收的热量依次增多
键键能依次减小,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
【答案】C
【解析】
A.原子形成化学键放热,焓变小于0,2H(g)+2X(g)=2HX(g)△H3<0,故A正确;
B.反应焓变与起始物质和终了物质有关于变化途径无关,途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3,故B正确;
C.![]() 键、
键、![]() 键、
键、![]() 键键能依次减小,断裂化学键需要能量减小,所以途径Ⅱ吸收的热量依次减小,故C错误;
键键能依次减小,断裂化学键需要能量减小,所以途径Ⅱ吸收的热量依次减小,故C错误;
D.因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,途径Ⅰ生成HCl放出的热量比生成HBr的多,说明氯化氢的能量低于溴化氢,能量越低越稳定,则HCl比HBr稳定,故D正确;
故答案为C。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】实验室铝热反应的实验装置如下:
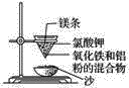
(1)下面放置盛细沙的____________(填名称)。
(2)镁条的作用是______________________________________。
(3)实验现象有:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(5)已知下表数据:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 |
①某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,当观察到___________________现象时,反应的离子方程式是________________________________________________________________________。
③实验室欲溶解此熔融物,最好选用下列试剂中的________(填字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.NaOH溶液