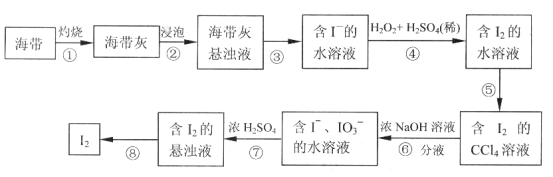
题目内容
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色的配合物,是合成其它一些含钴配合物的原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图,回答下列问题:
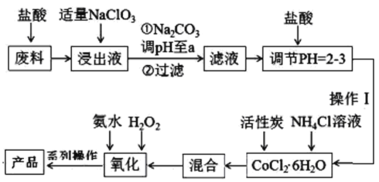
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“适量NaClO3”的作用是___,发生反应的离子方程式为___。
(2)“加Na2CO3调pH至a”会生成两种沉淀,分别为___(填化学式)。
(3)操作Ⅰ的步骤包括___、___、减压过滤。
(4)流程中“氧化”过程应先加入___(填“氨水”或“H2O2”),需水浴控温在50~60℃,温度不能过高,原因是___。写出“氧化”步骤发生反应的离子方程式:___,若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的___性。
【答案】将Fe2+转化为Fe3+ 6Fe2++ClO![]() +6H+=6Fe3++Cl-+3H2O Fe(OH)3和Al(OH)3 蒸发浓缩 冷却结晶 氨水 氨水温度过高会导致H2O2大量分解,降低产率 H2O2+2Co2++2NH
+6H+=6Fe3++Cl-+3H2O Fe(OH)3和Al(OH)3 蒸发浓缩 冷却结晶 氨水 氨水温度过高会导致H2O2大量分解,降低产率 H2O2+2Co2++2NH![]() +10NH3·H2O+6Cl-=2[Co(NH3)6]Cl3↓+12H2O 选择性
+10NH3·H2O+6Cl-=2[Co(NH3)6]Cl3↓+12H2O 选择性
【解析】
以含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3:用盐酸溶解废料,得到Co2+、Fe2+、Al3+的酸性溶液,加入适量的NaClO3将Fe2+氧化为Fe3+,再加Na2CO3调pH,沉淀Al3+、Fe3+为Fe(OH)3和Al(OH)3,过滤,得到滤液,向含有Co2+的溶液中加入盐酸调节pH=2-3,加入活性炭和NH4Cl溶液得到CoCl26H2O,再依次加入氨水和H2O2,发生反应:H2O2+2CoCl2+2NH4Cl+10NH3H2O=2[Co(NH3)6]Cl3↓+12H2O,再将沉淀在HCl氛围下蒸发浓缩、冷却结晶、减压过滤得到产品,据此分析作答。
(1)加“适量NaClO3”的目的是将Fe2+氧化为Fe3+,发生的离子反应为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(2)根据分析,加Na2CO3调pH,沉淀Al3+、Fe3+为Fe(OH)3和Al(OH)3;
(3)为防止产品水解,故[Co(NH3)6]Cl3应在HCl氛围下蒸发浓缩、冷却结晶、减压过滤;
(4)若先加H2O2,将Co元素氧化到Co3+,后加氨水,会生成Co(OH)3,不利于产品的生成,故先加入氨水再加入H2O2,可防止Co(OH)3的生成,双氧水受热易分解,氨水温度过高会导致H2O2大量分解,降低产率,因此需水浴控温在50~60℃,温度不能过高;“氧化”步骤发生反应的离子方程式:H2O2+2Co2++2NH![]() +10NH3·H2O+6Cl-=2[Co(NH3)6]Cl3↓+12H2O;若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的选择性。
+10NH3·H2O+6Cl-=2[Co(NH3)6]Cl3↓+12H2O;若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的选择性。

【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D