题目内容
【题目】某同学依照如下图所示流程提取海带中的碘元素。
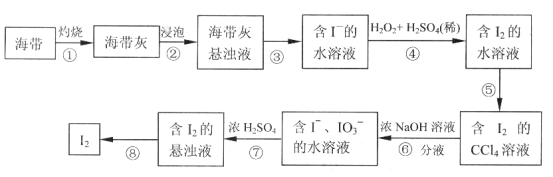
(1)步骤①中灼烧海带所用的仪器是__________(填序号)。
a.试管 b.坩埚 c.烧杯
(2)步骤④中用硫酸酸化的H2O2溶液将I-氧化成I2,反应的离子方程式是__________________。
(3)步骤⑤中采用的分离方法是___________________。
(4)经步骤⑤得到含I2的CCl4溶液后,继续采取步骤⑥⑦的目的是_______________。
(5)步骤⑦的反应中,当1molIO3-发生反应时,转移电子的物质的量是__________mol。
【答案】b 2I-+H2O2+2H+=I2+2H2O 萃取、分液 从I2的CCl4溶液中分离出I2 5
【解析】
海带在坩埚中进行灼烧后,将其加入蒸馏水溶解过滤除去不溶性杂质,加入稀硫酸酸化加入过氧化氢氧化碘离子为碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,蒸馏得到碘单质,根据氧化还原反应中电子转移数目相等进行有关氧化还原反应的计算,利用电子守恒、原子守恒、电荷守恒配平方程式。
(1)灼烧固体需要使用仪器坩埚,故合理选项是b;
(2)酸性条件下的H2O2作氧化剂,将I-氧化为I2,H2O2本身被还原为水,反应的离子方程式为:2I-+H2O2+2H+=I2+2H2O;
(3)由于I2在水中溶解度不大,而容易溶解在CCl4中,水与四氯化碳互不相容,所以可以用四氯化碳将碘单质从碘水中提取出来,提取碘的方法为萃取、分液;
(4)经步骤⑤得到含I2的CCl4溶液后,需要从I2的CCl4溶液中分离出I2;
(5)根据电子守恒、电荷守恒及原子守恒,可知发生反应为:5I-+IO3-+6H+=3I2+3H2O,可见由1mol IO3-发生反应时,转移5mol电子。

【题目】针对下表中的9种元素,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(1)写出⑧的原子结构示意图:_________________________。
(2)形成物质种类最多的元素是__________________。
(3)用电子式表示⑤和⑨形成化合物的过程__________________。
(4)⑤⑥⑦最高正价氧化物对应水化物碱性由强至弱的顺序是_____________。
(5)④的单质与甲醇(CH3OH)形成的碱性燃料电池的负极方程式:________________。
(6)写出⑦的单质与三氧化二铁反应的化学方程式____________________。
(7)③和④的气态氢化物的稳定性顺序为:______________。④和⑧的气态氢化物的沸点顺序为:_____________,出现这种变化的原因是:_____________。