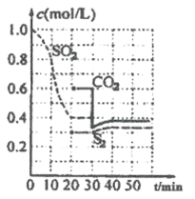
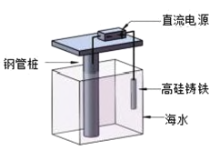
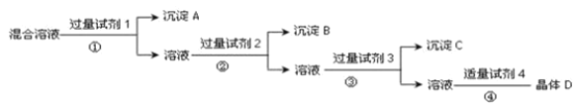
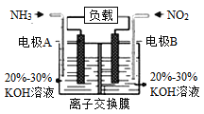
题目内容
【题目】酸性条件下,![]() 与
与![]() 按物质的量
按物质的量![]() 恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
(________)H++(________)NO2-+(________)I-→(_________)+(__________)+(__________)H2O
根据上述离子方程式,1摩尔![]() 参与反应则转移的电子数目是______,反应中被还原的元素是______。
参与反应则转移的电子数目是______,反应中被还原的元素是______。
【答案】4 2 2 I2 2NO↑ 2 ![]()
![]()
【解析】
由题干中“生成的产物能使淀粉溶液变蓝”可知生成物中有I2,碘元素化合价升高了,![]() 中N元素处于中间价态,具有氧化性,由此可知该反应的的氧化剂
中N元素处于中间价态,具有氧化性,由此可知该反应的的氧化剂![]() 被还原为NO,KI被中I-被氧化为I2,然后根据氧化还原反应的化合价升降相等并结合电荷守恒以及原子守恒进行配平;根据方程式中化合价升降计算转移电子数并同时分析出被还原的元素。
被还原为NO,KI被中I-被氧化为I2,然后根据氧化还原反应的化合价升降相等并结合电荷守恒以及原子守恒进行配平;根据方程式中化合价升降计算转移电子数并同时分析出被还原的元素。
由上述分析可知,氧化剂NaNO2中N元素化合价从+3将为NO中的+2价,降低1个化合价,I-中的I元素化合价从-1价升高为0价,升高1个化合价,令NO2-系数为1,则I-系数为1,NO系数为1,I2系数为0.5,然后根据电荷守恒可知H+系数为2,H2O的系数为1,然后将方程式中所有系数乘以2,可配平方程式为:4H++2NO2-+2I-=I2+2NO↑+2H2O;
根据上述分析,当有1molKI参加反应时,I元素化合价升高1,其转移的电子数目为NA;被还原的元素是N;
故答案为:4;2;2;I2;2NO↑;2;![]() ;
;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】向一个容积为2L的密闭容器中充入2mol NH3和3 mol O2,在恒温和催化剂作用下发生反应:4NH3(g)+5O2(g)4NO(g) + 6H2O(l) ,经过5min后达到平衡状态。此时,c(NH3):c(O2)=4:7。则:
(1)反应开始至平衡时,以NO的浓度变化表示该反应的平均速率v(NO)=__________。
(2)起始状态与平衡状态容器内的压强之比为______。
(3)该条件下反应一段时间,下列能说明反应达到平衡状态的是___________ 。
A.c(H2O)保持不变的状态 B.气体的压强保持不变的状态
C.4v正(NH3)=5v逆(O2) D.NH3与O2浓度之比保持不变的状态
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
A | B | C | D | E | F | |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1 = _________ ,V6 = _________ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________ 。