题目内容
【题目】碳酸和一水合氨是重要的弱酸和弱碱,常温下,其电离常数如下表所示。回答下列问题:
弱电解质 | H2CO3 | NH3·H2O | |
电离常数 |
|
|
|
(1)碳酸的一级电离方程式为______,二级电离常数表达式![]() ________。
________。
(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是_______(写化学式),混合溶液中![]() 、
、![]() 、
、![]() 、
、![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
(3)![]() 和
和![]() 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为![]() ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数![]() _______。(保留2位有效数字)。
_______。(保留2位有效数字)。
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则![]() +____+_____。
+____+_____。
【答案】![]()
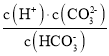
![]()
![]()
![]()
![]()
![]()
【解析】
本题考查电离、水解、离子浓度大小比较等,意在考查应用化学反应原理分析和解决问题的能力。
(1)H2CO3为二元弱酸,其一级电离生成![]() ,电离方程式为
,电离方程式为![]() ,二级电离方程式为
,二级电离方程式为![]() ,故其二级电离常数
,故其二级电离常数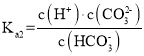 。故答案为:
。故答案为:![]() ;
;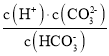 ;
;
(2)等物质的量的H2CO3和NH3·H2O反应生成酸式盐NH4HCO3。因![]() ,故
,故![]() 水解程度比
水解程度比![]() 大,则
大,则![]() ,因水解均较微弱,故
,因水解均较微弱,故![]()
![]() 。故答案为:NH4HCO3;
。故答案为:NH4HCO3;![]() ;
;
(3)常温下,由水解方程式可知该反应的平衡常数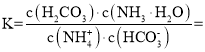
 。故答案为:
。故答案为:![]() ;
;
(4)室温下,向100mL 0.2mol·L-1NaHCO3溶液中加入100mL 0.2mol·L-1NH3·H2O溶液后,生成等物质的量的Na2CO3、(NH4)2CO3,由质子守恒得![]() ,也可由物料守恒和电荷守恒得出该结论。故答案为:
,也可由物料守恒和电荷守恒得出该结论。故答案为:![]() ;
;![]() ;
;

 阅读快车系列答案
阅读快车系列答案【题目】下列图像能说明或反映其对应关系的是( )
|
|
|
|
A | B | C | D |
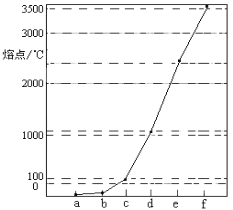
A.第二周期元素的化合价变化
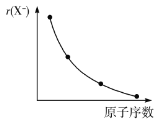
B.第ⅦA族元素简单阴离子的半径变化
C.向50 mL 0.5mol·L-1NaOH溶液中逐滴加入等浓度盐酸时溶液的pH变化
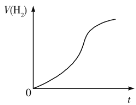
D.Al与稀硫酸反应产生H2的体积变化