题目内容
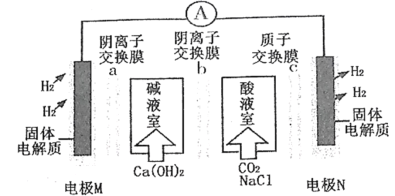
【题目】甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:

下列说法正确的是( )
A.N为正极,发生氧化反应
B.a为氧气,b为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池
【答案】D
【解析】
根据外电路中的电子的转移方向可知,M极失去电子,为负极,N极得电子,为正极,因甲醇燃料电池中反应物为甲醇和氧气,可判断a为甲醇,b为氧气,则M极的电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+, N极的电极反应式为:O2+4H++4e-=2H2O。
A.N为正极,得电子,发生还原反应,A错误;
B.a为甲醇,b为氧气,B错误;
C.装置中有质子交换膜,可推测电解质溶液为酸溶液,由M极的电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+可知,甲池中消耗水,则酸溶液的浓度增大,pH变小;乙池中消耗H+生成水,酸溶液pH变大,C错误;
D.若有1 mol CO2生成,根据CH3OH+H2O-6e-=CO2↑+6H+可知,电池中转移6mole-,根据![]() O2+6H++6e-=3H2O可知,则有6 mol H+从甲池透过交换膜进入乙池参与反应,D正确;
O2+6H++6e-=3H2O可知,则有6 mol H+从甲池透过交换膜进入乙池参与反应,D正确;
答案选D。

【题目】碳酸和一水合氨是重要的弱酸和弱碱,常温下,其电离常数如下表所示。回答下列问题:
弱电解质 | H2CO3 | NH3·H2O | |
电离常数 |
|
|
|
(1)碳酸的一级电离方程式为______,二级电离常数表达式![]() ________。
________。
(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是_______(写化学式),混合溶液中![]() 、
、![]() 、
、![]() 、
、![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
(3)![]() 和
和![]() 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为![]() ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数![]() _______。(保留2位有效数字)。
_______。(保留2位有效数字)。
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则![]() +____+_____。
+____+_____。
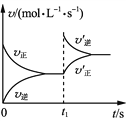
【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
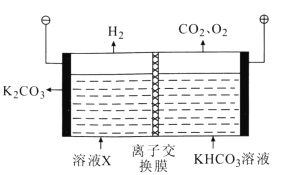
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。
【题目】下列各组物质中,能一步实现下图所示①~⑤转化关系的是

X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D