��Ŀ����
����Ŀ��ˮ������Ҫ�Ľ������ϣ�ˮ�����ϵ���Ҫ�ɷ�Ϊ![]() ��
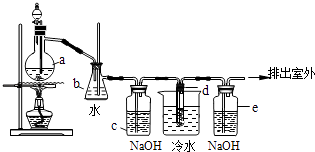
��![]() ��������һ��������������þ�Ƚ����������ʵ���Ҳⶨˮ����Ʒ�иƺ����Ĺ�����ͼ��ʾ��
��������һ��������������þ�Ƚ����������ʵ���Ҳⶨˮ����Ʒ�иƺ����Ĺ�����ͼ��ʾ��
�ش��������⣺
��1���ڷֽ�ˮ����Ʒ�����У�������Ϊ�ܼ����Ȼ��Ϊ���ܼ���������뼸�����ᣮ���������Ŀ����________������ʹ��________�������ᣮ
��2������![]() ����Ҫ�ɷ���________���䲻����ǿ�ᵫ����һ�����ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ_____________________________________________
����Ҫ�ɷ���________���䲻����ǿ�ᵫ����һ�����ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ_____________________________________________
��3���Ӱ�ˮ�����м��ȵ�Ŀ����__________________������![]() ����Ҫ�ɷ�Ϊ________��________���ѧʽ����
����Ҫ�ɷ�Ϊ________��________���ѧʽ����
��4������Ƴ�����ϡ![]() ��������
��������![]() ����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ������ζ���ӦΪ��
����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ������ζ���ӦΪ�� ![]() ��ʵ���г�ȡ
��ʵ���г�ȡ![]() ˮ����Ʒ���ζ�ʱ������
ˮ����Ʒ���ζ�ʱ������![]() ��
��![]() ��Һ
��Һ![]() �����ˮ����Ʒ�иƵ���������Ϊ________��
�����ˮ����Ʒ�иƵ���������Ϊ________��
���𰸡� ����Ʒ�е�![]() ����Ϊ
����Ϊ![]()
![]()
![]()
![]() ��ֹ��������
��ֹ�������� ![]()
![]() 45.0%
45.0%
����������������Ϣ��֪��ˮ����Ʒ���Ȼ�李����ᡢ����Ļ��Һ��ȡ���˳��������������ȣ�������Һ�мӰ�ˮ����pH���������ӡ������ӵ��������ӳ������ٹ���������Һ�м������藺Ѹ����ӳ����������������ܽ��õ����ᣬ����ø��������Һ�ζ���
��1���ڷֽ�ˮ����Ʒ�����У�������Ϊ�ܼ����Ȼ��Ϊ���ܼ���������뼸�����ᣮ���������Ŀ���ǽ���Ʒ�е�![]() ����Ϊ���׳�����
����Ϊ���׳�����![]() ������ʹ��
������ʹ��![]() �������ᣮ
�������ᣮ
��2������![]() ����Ҫ�ɷ���
����Ҫ�ɷ���![]() ���䲻����ǿ�ᵫ��������ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ
���䲻����ǿ�ᵫ��������ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��3���Ӱ�ˮ�����м��ȵ�Ŀ���Ƿ�ֹ�����������������������ӵij���������![]() ����Ҫ�ɷ�Ϊ
����Ҫ�ɷ�Ϊ![]() ��
��![]() ��
��
��4������Ƴ�����ϡ![]() ��������
��������![]() ����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ������ζ���ӦΪ��
����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ������ζ���ӦΪ�� ![]() ��ʵ���г�ȡ
��ʵ���г�ȡ![]() ˮ����Ʒ���ζ�ʱ������
ˮ����Ʒ���ζ�ʱ������![]() ��
��![]() ��Һ
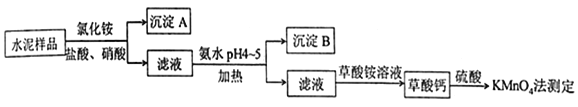
��Һ![]() ���ɸ�����Ӧ�Ļ�ѧ����ʽ���Եõ���ϵʽ5Ca2+~5
���ɸ�����Ӧ�Ļ�ѧ����ʽ���Եõ���ϵʽ5Ca2+~5![]() ~
~![]() ~2
~2![]() ��n(Ca2+)=
��n(Ca2+)=![]() n(
n(![]() )=
)=![]() ,�����Ʒ�иƵ���������Ϊ
,�����Ʒ�иƵ���������Ϊ![]() 45.0%��
45.0%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��������ʵ�鼰�������Ƴ���Ӧ���۵��ǣ� ��
ʵ�� | ���� | ���� | |
| ��2mL0.1mol/L FeCl3 ��Һ�м��������ۣ����� | ��ɫ����ʧ���� | ��ԭ�ԣ� |
| ����������ȼ�ճ��е�ȼ��Ѹ�����뼯�� | ����ƿ�в����������̣�ƿ���к�ɫ�������� |
|
| ����ʢ������ | ʯ����ֽ���� |
|
| �� | һ֧�Թ��в�����ɫ��������һ֧������������ |
|
A. A B. B C. C D. D