题目内容
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐![]() (用
(用![]() 代表).回答下列问题:
代表).回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为________.
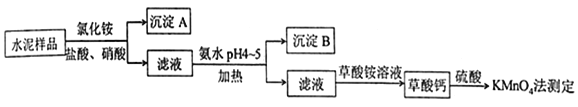
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能![]() .第二周期部分元素的
.第二周期部分元素的![]() 变化趋势如图
变化趋势如图![]() 所示,其中除氮元素外,其他元素的
所示,其中除氮元素外,其他元素的![]() 自左而右依次增大的原因是________;氮元素的
自左而右依次增大的原因是________;氮元素的![]() 呈现异常的原因是________.
呈现异常的原因是________.
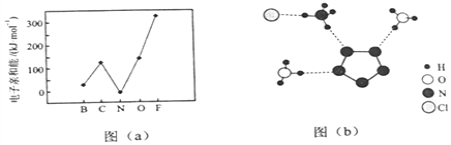
(3)经![]() 射线衍射测得化合物
射线衍射测得化合物![]() 的晶体结构,其局部结构如图
的晶体结构,其局部结构如图![]() 所示.
所示.
①从结构角度分析, ![]() 中两种阳离子的相同之处为________,不同之处为________.(填标号)
中两种阳离子的相同之处为________,不同之处为________.(填标号)
![]() .中心原子的杂化轨道类型
.中心原子的杂化轨道类型 ![]() .中心原子的价层电子对数
.中心原子的价层电子对数
![]() .立体结构
.立体结构 ![]() .共价键类型
.共价键类型
②![]() 中阴离子
中阴离子![]() 中的
中的![]() 键总数为________个.分子中的大
键总数为________个.分子中的大![]() 键可用符号
键可用符号![]() 表示,其中
表示,其中![]() 代表参与形成的大
代表参与形成的大![]() 键原子数,
键原子数, ![]() 代表参与形成的大
代表参与形成的大![]() 键电子数(如苯分子中的大
键电子数(如苯分子中的大![]() 键可表示为Π
键可表示为Π![]() ),则
),则![]() 中的大
中的大![]() 键应表示为________.
键应表示为________.
③图![]() 中虚线代表氢键,其表示式为
中虚线代表氢键,其表示式为![]() 、________、________.
、________、________.
(4)![]() 的晶体密度为
的晶体密度为![]() ,其立方晶胞参数为
,其立方晶胞参数为![]() ,晶胞中含有
,晶胞中含有![]() 个
个![]() 单元,该单元的相对质量为
单元,该单元的相对质量为![]() ,则
,则![]() 的计算表达式为________.
的计算表达式为________.
【答案】 ![]() 同周期元素随核电荷数依次增大,原子半径逐渐变小,得电子能力逐渐增强,故结合一个电子释放出的能量依次增大 N原子的2p轨道处于较稳定的半充满状态,所以不易结合一个电子 ABD C 5
同周期元素随核电荷数依次增大,原子半径逐渐变小,得电子能力逐渐增强,故结合一个电子释放出的能量依次增大 N原子的2p轨道处于较稳定的半充满状态,所以不易结合一个电子 ABD C 5 ![]()
![]() (H3O+)O-H…N(
(H3O+)O-H…N(![]() )
) ![]()
【解析】(1)氮原子价层电子对的轨道表达式(电子排布图)为![]() .
.
(2)第二周期除氮元素外,其他元素的![]() 自左而右依次增大的原因是:同周期元素随核电荷数依次增大,原子半径逐渐变小,得电子能力逐渐增强,故结合一个电子释放出的能量依次增大;氮元素的
自左而右依次增大的原因是:同周期元素随核电荷数依次增大,原子半径逐渐变小,得电子能力逐渐增强,故结合一个电子释放出的能量依次增大;氮元素的![]() 呈现异常的原因是:N原子的2p轨道处于较稳定的半充满状态,所以不易结合一个电子.
呈现异常的原因是:N原子的2p轨道处于较稳定的半充满状态,所以不易结合一个电子.
(3)①从结构角度分析, ![]() 中两种阳离子(铵根离子和水合氢离子)的相同之处有中心原子的杂化轨道类型都是sp3杂化、中心原子的价层电子对数都是4、共价键类型都是极性键等3个方面,故选ABD;不同之处为离子的立体结构不同,铵根离子为正四面体、水合氢离子为三角锥形,故选C.
中两种阳离子(铵根离子和水合氢离子)的相同之处有中心原子的杂化轨道类型都是sp3杂化、中心原子的价层电子对数都是4、共价键类型都是极性键等3个方面,故选ABD;不同之处为离子的立体结构不同,铵根离子为正四面体、水合氢离子为三角锥形,故选C.
②由![]() 的结构示意图可知,其中阴离子
的结构示意图可知,其中阴离子![]() 中的
中的![]() 键总数为5个,每个N形成2个
键总数为5个,每个N形成2个![]() 键,每个N原子还剩余1个2p轨道的电子,
键,每个N原子还剩余1个2p轨道的电子, ![]() 带一个单位的负电荷(得到一个电子),所以共有5个N原子、6个电子参与形成大
带一个单位的负电荷(得到一个电子),所以共有5个N原子、6个电子参与形成大![]() 键,
键, ![]() 中的大
中的大![]() 键应表示为
键应表示为![]() .
.
③图![]() 中虚线代表氢键,由图可知,R中共有3种氢键,其表示式分别为
中虚线代表氢键,由图可知,R中共有3种氢键,其表示式分别为![]() 、
、![]() 、(H3O+)O-H…N(
、(H3O+)O-H…N(![]() ).
).
(4)![]() 的晶体密度为
的晶体密度为![]() ,其立方晶胞参数为
,其立方晶胞参数为![]() ,晶胞中含有
,晶胞中含有![]() 个
个![]() 单元,该单元的相对质量为
单元,该单元的相对质量为![]() ,则NA个晶胞的质量和体积分别为
,则NA个晶胞的质量和体积分别为![]() 和
和![]() ,所以晶体的密度
,所以晶体的密度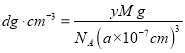 ,解之得,
,解之得, ![]() 的计算表达式为
的计算表达式为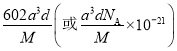 .
.

 阅读快车系列答案
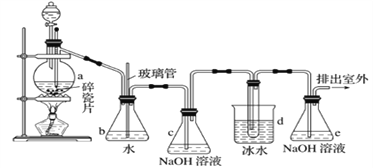
阅读快车系列答案【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
已知:Ⅰ.CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3(乙醚)+H2O
CH3CH2OCH2CH3(乙醚)+H2O
Ⅱ.相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)已知条件Ⅰ中有两个反应,其中第二个反应所属反应类型为____________________。
(2)实验中应迅速将温度升高到170℃左右的原因是______________________________。
(3)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是_______________________________________________;安全瓶b还可以起到的作用是__________________
(4)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(6)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。