题目内容
8.下列各微粒属于等电子体的是( )| A. | N2O4和 NO2 | B. | CH4和 NH4+ | C. | CO2 和NO2 | D. | C2H6 和N2H6 |
分析 原子数相同,电子总数相同的分子,互称为等电子体,分别计算两微粒的电子数结合微粒中原子数进行分析解答.
解答 解:A.N2O4的电子数为7×2+8×4=46,NO2的电子数为7+8×2=23,二者电子数不相同,所以不是等电子体,故A错误;
B.CH4、NH4+中原子数相同,CH4电子总数为 6+1×4=10,NH4+中电子数为:7+1×4-1=10,二者电子数也相同,属于等电子体,故B正确;
C.CO2 和NO2原子数相同,CO2电子数是22,NO2的电子数是23,电子数不等,所以不是等电子体,故C错误;
D.C2H6和N2H6中原子数相同,C2H6电子总数为 6×2+1×6=18,N2H6中电子数为:7×2+1×6=20,二者电子数不同,故D错误;
故选B.
点评 本题考查了等电子体的判断,明确原子数相同,电子总数相同的分子互称为等电子体即可解答,题目难度不大.

练习册系列答案
相关题目
18.NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 常温下,1 L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含有58.5 g氯化钠的溶液中含有NA个氯化钠分子 | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4 L乙烯中C-H的个数为4NA |
16.有一透明溶液甲,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Ba2+、SO42-、Cl-、I-、HCO3-,现取该溶液实验如表:
(1)由实验步骤①判断出溶液中肯定不存在的离子是HCO3-,能说明这一实验事实的离子方程式是H++HCO3-=CO2↑+H2O
(2)实验步骤③的实验结果说明溶液中不存在I-离子
(3)欲确定的离子中肯定存在的是Mg2+、Al3+、Cl-.
(4)为进一步确定其他离子,应该补充的实验是C
A.蒸发 B.过滤C.焰色反应 D.渗析.
| 实验步骤 | 实验现象 |
| ①取少量甲溶液,滴加几滴甲基橙 | 溶液变红色 |
| ②取少量甲溶液,滴加Ba(NO3)2溶液 | 溶液无明显变化 |
| ③取②中实验后的溶液,滴加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ④取少量甲溶液,滴加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(2)实验步骤③的实验结果说明溶液中不存在I-离子
(3)欲确定的离子中肯定存在的是Mg2+、Al3+、Cl-.
(4)为进一步确定其他离子,应该补充的实验是C
A.蒸发 B.过滤C.焰色反应 D.渗析.
13.下列原子轨道中,轨道数为5的是( )
| A. | 5s | B. | 3d | C. | 5p | D. | 5f |
20.我国新修订的《环境保护法》已于2015年1月1日起施行,体现了加强生态文明建设的新要求.下列行为不符合这一要求的是( )
| A. | 大力建设火力发电站,充分利用我国煤资源丰富的国情特点 | |
| B. | 发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖 | |
| C. | 推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料 | |
| D. | 推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气 |
17.下列说法正确的是( )
| A. | HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s);△H=-26.5kJ/mol,由此可知I2(s)+H2(g)?2 HI(g);△H=+26.5kJ/mol | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| D. | 放热反应在常温下一定很容易发生 |
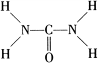 .另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.请回答下列问题:
.另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.请回答下列问题: