题目内容
3.尿素是目前含氮量最高的氮肥,作为一种中性肥料,尿素适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.已知尿素的结构式为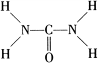 .另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.请回答下列问题:
.另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.请回答下列问题:(1)基态Fe3+的核外电子排布式为1s22s22p63s23p63d5;C、N、O三种元素的电负性由大到小的顺序是N>O>C.
(2)尿素分子中N原子的杂化方式是sp3.三硝酸六尿素合铁(Ⅲ)中的NO3-空间构型是平面三角形.
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5.Fe(CO)在一定条件下发生反应:Fe(CO)x(s)═Fe(s)+xCO(g),已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有金属键.
(4)铁的金属密堆积方式为体心立方结构,结构如图所示.
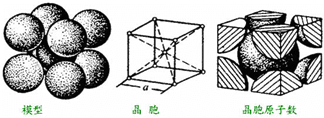
则晶胞中铁原子的配位数为8.如果铁原子的半径为r pm,密度为b g•cm-3,则铁原子的摩尔质量为$\frac{1}{2}b×(\frac{4\sqrt{3}}{3}r×1{0}^{-10})^{3}{N}_{A}$/mol.(不必计算结果,NA为阿伏加徳罗常数)
分析 (1)Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素;
(2)尿素分子中N原子的价层电子对数为$\frac{5+3}{2}$=4,NO3-中N原子的价层电子对数为$\frac{5+1}{2}$=3,据此判断;
(3)分子晶体的熔沸点较低;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;根据生成物判断形成的化学键;
(4)体心立方结构的配位数为8;利用均摊法计算晶胞中含有1+8×$\frac{1}{8}$=2个铁原子,根据$ρ=\frac{m}{V}$=$\frac{\frac{2M}{{N}_{A}}}{V}$计算摩尔质量.
解答 解:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:1s22s22p63s23p63d5;N>O>C;
(2)尿素分子中N原子的价层电子对数为$\frac{5+3}{2}$=4,所以N原子的杂化方式为sp3,NO3-中N原子的价层电子对数为$\frac{5+1}{2}$=3,氮原子没有孤电子对,所以NO3-空间构型是平面三角形,
故答案为:sp3;平面三角形;
(3)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,
故答案为:分子晶体;5;金属键;
(4)铁的金属密堆积方式为体心立方结构,晶胞中铁原子的配位数为8;体心立方中含有1+8×$\frac{1}{8}$=2个铁原子,晶胞中体对角线上为三个铁原子相切,则体对角线为4r×10-10cm,晶胞边长为:$\frac{4\sqrt{3}}{3}$r×10-10cm,晶胞体积为:($\frac{4\sqrt{3}}{3}$r×10-10cm)3,所以根据$ρ=\frac{m}{V}$=$\frac{\frac{2M}{{N}_{A}}}{V}$可知,M=$\frac{1}{2}ρV{N}_{A}$=$\frac{1}{2}b×(\frac{4\sqrt{3}}{3}r×1{0}^{-10})^{3}{N}_{A}$/mol,
故答案为:8;$\frac{1}{2}b×(\frac{4\sqrt{3}}{3}r×1{0}^{-10})^{3}{N}_{A}$g/mol.
点评 本题考查核外电子排布规律、杂化轨道理论、络合物、晶胞计算等,难度中等,注意等电子体为原子总数相等,核外电子总数或价电子总数相等的微粒

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案| A. | 铜粉溶于FeCl3溶液的离子方程式:Cu+Fe3+=Cu2++Fe2+ | |
| B. | 将Na2O2固体投入H218O中:2H218O+2Na2O2═4OH-+4Na++18O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| A. | 盐酸 | B. | 二氧化碳 | C. | 硝酸 | D. | 乙醇 |
| A. | 水 | B. | 食盐 | C. | 纯碱 | D. | 酒精 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点:H2T<H2R | B. | M与T形成的化合物具有两性 | ||
| C. | 单质与稀盐酸反应的速率:L<Q | D. | L2+与R2-的核外电子数相等 |
| A. | N2O4和 NO2 | B. | CH4和 NH4+ | C. | CO2 和NO2 | D. | C2H6 和N2H6 |
 ,C离子的电子排布式为1s22s22p63s23p6
,C离子的电子排布式为1s22s22p63s23p6

 .
. .物质K的结构简式
.物质K的结构简式 .
.