题目内容
18.NA表示阿伏加德罗常数的值.下列叙述中正确的是( )| A. | 常温下,1 L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含有58.5 g氯化钠的溶液中含有NA个氯化钠分子 | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4 L乙烯中C-H的个数为4NA |
分析 A、求出硝酸铵的物质的量,然后根据1mol硝酸铵中含2mol氮原子来分析;
B、氯化钠为离子晶体;
C、KIO3+6HI═KI+3I2+3H2O反应转移5mol电子,生成3mol碘单质;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、硝酸铵的物质的量n=CV=0.1mol/L×1L=0.1mol,而1mol硝酸铵中含2mol氮原子,故0.1mol硝酸铵中含0.2mol氮原子即0.2NA个,故A正确;
B、氯化钠为离子晶体,故氯化钠中无氯化钠分子,故B错误;
C、KIO3+6HI═KI+3I2+3H2O反应转移5mol电子,生成3mol碘单质,故生成3mol碘单质的时候转移5mol电子即5NA个,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L乙烯的物质的量小于1mol,故含有的C-H键个数少于4NA条,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大..

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
18.将100mL 0.1mol/L K2CO3溶液与pH=13的Ba(OH)2溶液等体积混合,要使其滤液的pH=7,应加入1mol/L盐酸的体积为( )
| A. | 10mL | B. | 20mL | C. | 40mL | D. | 60mL |
13.下列离子方程式正确的是( )
| A. | 铜粉溶于FeCl3溶液的离子方程式:Cu+Fe3+=Cu2++Fe2+ | |
| B. | 将Na2O2固体投入H218O中:2H218O+2Na2O2═4OH-+4Na++18O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
3.已知C5H11Br有8种同分异构体,则C6H12O属于醛的结构有( )
| A. | 16种 | B. | 11种 | C. | 8种 | D. | 6种 |
10.将11.2g铁粉投入40ml较浓的HNO3中,完全反应时收集到NO和NO2混合气体1792ml(标准状况),还残留5.6g固体.则原HNO3的物质的量浓度为( )
| A. | 3.5mol/l | B. | 4.5mol/l | C. | 7.0mol/l | D. | 9.0mol/l |
8.下列各微粒属于等电子体的是( )
| A. | N2O4和 NO2 | B. | CH4和 NH4+ | C. | CO2 和NO2 | D. | C2H6 和N2H6 |


 .
. ;有机物C还具有的性质有bd
;有机物C还具有的性质有bd ;
;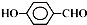 .
.