��Ŀ����
����Ŀ����ҵ�ϳ������µķ����Ӻ�ˮ�����壺
Ũ����ˮ![]() �ֲ�Ʒ��
�ֲ�Ʒ��![]() ������
������![]() ����X
����X ![]() ��Ʒ��
��Ʒ��
���������գ�
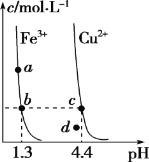
��1���������������������漰�����������������������Ļ�ѧ�������ǣ�_____���嵥�ʵĵ���ʽ��_________���������̬�⻯��ķе�Ƚϣ�___________>___________����д��ѧʽ����д��һ�ֺ���Ԫ�صĻ����������ڷǼ��Է��ӵĻ�ѧʽ_____��
��2����������������嵥�ʾ��е�������_____��
��3��д��������з�Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ����˵������Ӧ��ˮ���������������ɣ���_____���ڸ÷�Ӧ�б�������Ԫ���ǣ�_____��
��4����ҵ�����ú�ˮ����һ����Ҫ�ķ�Ӧ���ǵ�ⱥ��ʳ��ˮ���˷�Ӧ�е����������ǣ�_____��______________��д��ѧʽ����
���𰸡����ۼ� ![]() HBr HCl CCl4 �е��
HBr HCl CCl4 �� 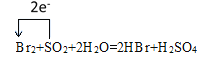 S NaOH H2
S NaOH H2
��������
��1��±�ص������ڹ��۷��ӣ������д��ڹ��ۼ���±��Ԫ�ش��ȵ��⣬����̬�⻯��ķе������ߣ�CCl4���ڷǼ��Է��ӣ�
��2������зе�ͣ��ӷ������ʣ�
��3���������Ͷ�������Ӧ�����������������ݷ�Ӧ��1molSO2��ȫ�������������֪��ת��2mol���ӣ�����÷�Ӧ�е���ת�Ƶķ������Ŀ����Ӧ��������Ԫ�ػ��ϼ����ߣ�������������Ӧ��
��4����ⱥ��ʳ��ˮ�ķ�ӦΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+ H2��������������ԭ��Ӧ���ݴ˷��������IJ��
2NaOH+Cl2��+ H2��������������ԭ��Ӧ���ݴ˷��������IJ��
��1���������ɷǽ���Ԫ����ɣ���ԭ�Ӻ���ԭ��֮����ڵ��ǹ��ۼ�������8�����ȶ��ṹ���Եó����嵥�ʵĵ���ʽΪ![]() ��±��Ԫ�ش��ȵ��⣬����̬�⻯��ķе������ߣ��ʷе�HBr>HCl��CCl4�Ǻ���Ԫ�صĻ����������ڷǼ��Է��ӣ�
��±��Ԫ�ش��ȵ��⣬����̬�⻯��ķе������ߣ��ʷе�HBr>HCl��CCl4�Ǻ���Ԫ�صĻ����������ڷǼ��Է��ӣ�
�ʴ��ǣ����ۼ���![]() ��HBr��HCl��CCl4��
��HBr��HCl��CCl4��
��2�������ͨ��ͨ�������ˮ��������Һ̬��������������������е�ͣ��ӷ������ʡ�
�ʴ��ǣ��е�ͣ�
��3����������������Ͷ�������Ӧ���仯ѧ����ʽΪ��Br2+SO2+2H2O=2HBr+H2SO4��+4�������ߵ�+6�ۣ�����1molSO2��ȫ������ת��2mol���ӣ�����ת�Ƶķ������ĿΪ��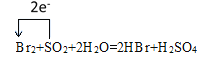 ���ڸ÷�Ӧ��SԪ�صĻ��ϼ۷����˱仯���ɶ��������е�+4���������е�+6�ۣ���˱�������Ԫ����S��
���ڸ÷�Ӧ��SԪ�صĻ��ϼ۷����˱仯���ɶ��������е�+4���������е�+6�ۣ���˱�������Ԫ����S��
�ʴ��ǣ� 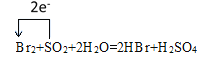 ��S��
��S��
��4����ⱥ��ʳ��ˮ�ķ�ӦΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+ H2��������������ԭ��Ӧ�����������������ĵ缫����ʽ��2H2O+2e��=H2��+2OH- ��������Ũ�ȼ�С�������������������������������ƣ�����������ΪNaOH��H2��
2NaOH+Cl2��+ H2��������������ԭ��Ӧ�����������������ĵ缫����ʽ��2H2O+2e��=H2��+2OH- ��������Ũ�ȼ�С�������������������������������ƣ�����������ΪNaOH��H2��
�ʴ��ǣ�NaOH��H2��