题目内容
【题目】某两种金属粉末的混合物25g,投入足量的稀硫酸中,在标况下产生氢气11.2L,则该混合物可能是
A.铝和镁B.镁和铁C.铁和铜D.铁和锌
【答案】B
【解析】
假设为一种物质产生氢气,则产生1mol氢气须该物质50g,铝、镁、铁、锌产生1mol氢气所需的质量分别为:18g、24g、56g、65g,铜不能与稀硫酸反应产生氢气,理解为其产生1mol氢气需要质量为无穷大。由上分析可知,要用两种物质满足条件,则需要平均摩尔氢气分子量为50,即要在50两侧。上述物质中,小于50的有:铝、镁;大于50的有铁、锌、铜,一大一小搭配,答案选B。

练习册系列答案
相关题目
【题目】保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
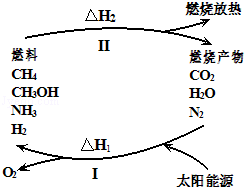
过程I可用如下反应表示:
①2CO2![]() 2CO+O2
2CO+O2
②2H2O![]() 2H2+O2
2H2+O2
③2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
④2CO2+4H2O![]() 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+H2O![]() +3O2
+3O2
请回答下列问题:
(1)过程I的能量转化形式为: 能转化为 能.
(2)请完成第⑤个反应的化学方程式
(3)上述转化过程中,△H1和△H2的关系是
(4)断裂1mol化学键所需的能量见表:
共价键 | H﹣N | H﹣O | N≡N | O=O |
断裂1mol化学键所需能量/kJmol﹣1 | 393 | 460 | 941 | 499 |
常温下,N2和H2O反应生成NH3的热化学方程式为