题目内容
常温下,有下列四种溶液:
下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/L NH3?H2O溶液 |
pH=11 NaOH溶液 |
pH=1 H2SO4溶液 |
pH=3 CH3COOH溶液 |
| A、①与③等体积混合,溶液pH<7 |
| B、②与④等体积混合,溶液pH>7 |
| C、将VmL④的溶液浓缩到10-2VmL后,pH与③相同 |
| D、②与③混合,若溶液pH=7,则V(NaOH):V(H2SO4)=100:1 |
分析:A、①与③等体积混合,二者恰好反应生成硫酸铵,铵离子水解,溶液显示酸性;
B、②与④等体积混合,醋酸为弱电解质,醋酸过量,溶液显示酸性;
C、对应强电解质,溶液体积缩小100倍,溶液的pH减小2,但醋酸为弱电解质,浓度增大,醋酸的电离程度减小,氢离子浓度减小,溶液的pH大于1;
D、氢氧化钠和硫酸都是强电解质,pH=11的NaOH溶液中氢氧根离子浓度为0.001mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,据此计算出若满足溶液pH=7,需要两溶液的体积.
B、②与④等体积混合,醋酸为弱电解质,醋酸过量,溶液显示酸性;
C、对应强电解质,溶液体积缩小100倍,溶液的pH减小2,但醋酸为弱电解质,浓度增大,醋酸的电离程度减小,氢离子浓度减小,溶液的pH大于1;
D、氢氧化钠和硫酸都是强电解质,pH=11的NaOH溶液中氢氧根离子浓度为0.001mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,据此计算出若满足溶液pH=7,需要两溶液的体积.
解答:解:A、氨水为弱碱,①与③等体积混合,两溶液恰好完全反应生成硫酸铵,铵离子部分水解,所以溶液显示酸性,溶液pH<7,故A正确;
B、醋酸为弱电解质,pH=3的醋酸溶液的浓度大于0.001mol/L,所以②与④等体积混合,醋酸过量,反应后溶液显示酸性,溶液pH<7,故B错误;
C、醋酸为弱电解质,浓度越大,电离程度越小,所以pH=3的醋酸溶液的体积缩小100倍,溶液中氢离子增大倍数小于100,溶液的pH大于1,故C错误;
D、pH=11的NaOH溶液中氢氧根离子浓度为0.001mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,氢氧根离子浓度是氢离子浓度的
,若满足溶液显示中性,则V(NaOH):V(H2SO4)=100:1,故D正确;
故选AD.
B、醋酸为弱电解质,pH=3的醋酸溶液的浓度大于0.001mol/L,所以②与④等体积混合,醋酸过量,反应后溶液显示酸性,溶液pH<7,故B错误;
C、醋酸为弱电解质,浓度越大,电离程度越小,所以pH=3的醋酸溶液的体积缩小100倍,溶液中氢离子增大倍数小于100,溶液的pH大于1,故C错误;
D、pH=11的NaOH溶液中氢氧根离子浓度为0.001mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,氢氧根离子浓度是氢离子浓度的
| 1 |
| 100 |
故选AD.
点评:本题考查了pH的简单计算、弱电解质的电离平衡,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确弱电解质在溶液中部分电离,选项C为易错点和难点.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目



 +NaHCO3→
+NaHCO3→ +CO2↑+H2O
+CO2↑+H2O
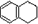 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: