题目内容
【题目】某课题组对某样品W(组成用CxHyOzNaSb表示)进行探究。
实验一:确定W中元素组成
(1)取W样品,将有机氮转化成NH4+,_____________(补充实验方案),证明W中含氮元素。
(2)用燃烧法确定W样品中含碳、氢、硫三种元素,装置如图所示。
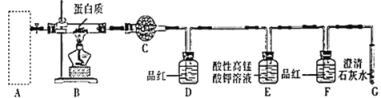
①A框内是加热固体制备氧气发生装置,写出A中反应的化学方程式:__________________。
②写出E中发生反应的离子方程式:_________________。
③从实验简约性考虑,D、E、F、G装置可以用下列装置替代:
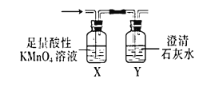
能证明W含碳元素的实验现象是__________________。
实验二:测定W中硫元素含量
(3)取wgW样品在过量的氧气中充分燃烧,用V1mLc1mol·L-1碘水溶液吸收SO2,用V2mLc2mol·L-1Na2S2O3溶液滴定过量的I2。已知:2Na2S2O3+I2=2NaI+Na2S4O6。滴定终点的标志是__________________。该W样品中硫元素的质量分数为_________%。
(4)二氧化硫通入吸收液前必须通过过量的赤热铜粉(SO2不参与反应),否则会导致测定的硫元素质量分数_________(填“偏高”“偏低”或“无影响”)。
【答案】 加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验生成的气体,试纸变蓝色 2KClO3![]() 2KCl+3O2↑(或2KMnO4
2KCl+3O2↑(或2KMnO4![]() K2MnO4+MnO2+O2↑) 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ X中颜色变浅色,但不褪色;Y中变浑浊 滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复
K2MnO4+MnO2+O2↑) 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ X中颜色变浅色,但不褪色;Y中变浑浊 滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复 ![]() 偏低
偏低
【解析】实验一(确定W中元素组成):必须使用干燥氧气,A是发生装置,通过加热固体制备氧气,注意不能用双氧水制氧气。用无水硫酸铜检验H2O,D装置用于检验SO2,E装置用于除去SO2,F装置用于确定SO2是否除尽,因为SO2会干扰CO2的检验;
实验二(测定W中硫元素含量):根据SO2+I2+2H2O=2HI+H2SO4,2Na2S2O3+I2=2NaI+Na2S4O6。有:n(SO2)+![]() n(Na2S2O3)=n(I2),据此分析计算硫元素的质量分数;过量的氧气混在SO2气体中,会发生2SO2+O2+2H2O=2H2SO4,据此分析判断误差。
n(Na2S2O3)=n(I2),据此分析计算硫元素的质量分数;过量的氧气混在SO2气体中,会发生2SO2+O2+2H2O=2H2SO4,据此分析判断误差。
(1)检验铵离子,操作要点是加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验,现象是由红色变蓝色,故答案为:加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验生成的气体,试纸变蓝色;
(2)①通过加热固体制备氧气,应该是加热高锰酸钾或氯酸钾分解制备氧气,反应的方程式为2KClO3![]() 2KCl+3O2↑(或2KMnO4
2KCl+3O2↑(或2KMnO4![]() K2MnO4+MnO2+O2↑),故答案为:2KClO3
K2MnO4+MnO2+O2↑),故答案为:2KClO3![]() 2KCl+3O2↑(或2KMnO4
2KCl+3O2↑(或2KMnO4![]() K2MnO4+MnO2+O2↑);
K2MnO4+MnO2+O2↑);
②用无水硫酸铜检验H2O,D装置用于检验SO2,E装置用于除去SO2,F装置用于确定SO2是否除尽,因为SO2会干扰CO2的检验。因此E中反应为2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4,离子方程式为2MnO4+5SO2+2H2O=2Mn2++5SO42+4H,故答案为:2MnO4+5SO2+2H2O=2Mn2++5SO42+4H;
③从简约装置看,X装置中试剂“过量”,它有三个作用:检验SO2、除去SO2、确认SO2除尽,实验现象是紫色溶液变浅——检验并除去SO2,不褪色——说明SO2已除尽了,最后Y中变浑浊,才能证明W中含碳元素,故答案为:X中颜色变浅色,但不褪色;Y中变浑浊;
(3)用硫代硫酸钠溶液滴定过量的I2,用淀粉溶液作指示剂。滴定前碘使淀粉溶液变蓝色,当碘完全消耗时蓝色变无色。根据SO2+I2+2H2O=2HI+H2SO4,2Na2S2O3+I2=2NaI+Na2S4O6。有:2n(SO2)+n(Na2S2O3)=2n(I2),ω(S)=![]() ×
××100%=
![]() %,故答案为:滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复;
%,故答案为:滴加最后一滴时溶液由蓝色恰好变为无色且半分钟不恢复;![]() ;
;
(4)氧化W时,O2过量,过量的氧气混在SO2气体中,用赤热铜粉除去O2。如果不除去氧气,在水溶液中会发生反应:2SO2+O2+2H2O=2H2SO4,结果测得V2偏大,测得S元素质量分数偏低,故答案为:偏低。

