题目内容
20.一定质量的碳和8g氧气在密闭容器置于高温下反应,恢复到原来温度,测得容器内的压强变为原来的1.4倍,求参与反应的碳的质量.分析 根据阿伏加德罗定律可知温度体积保持不变时,压强于物质的量成正比,C+O2=CO2,2C+O2=2CO,由上述方程式可看出只发生前者则压强与原来的相同,只发生后者则压强是原来的2倍;而现测得容器内压强比原来大0.4倍,说明上述两反应发生,即生成CO2和CO的混合物,由此分析解答;
解答 解:根据阿伏加德罗定律可知温度体积保持不变时,压强于物质的量成正比,C+O2=CO2,2C+O2=2CO,由上述方程式可看出只发生前者则压强与原来的相同,只发生后者则压强是原来的2倍;而现测得容器内压强比原来大0.4倍,说明上述两反应发生,即生成CO2和CO的混合物,8克氧气为0.25mol,反应后气体(CO2和CO)总物质的量为0.25×1.4=0.35mol,这两种气体都是每摩尔中含1mol碳原子,所以参加反应的炭为0.35mol,参与反应的碳的质量为4.2克,
答:参与反应的碳的质量为4.2克.
点评 本题主要考查学生对完全反应和不完全反应以及物质在反应中的质量关系的认识.解题时,学生需根据化学方程式认真分析物质在反应中的质量关系,才能正确解答.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
11.关于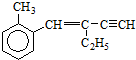 下列结论正确的是( )
下列结论正确的是( )
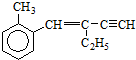 下列结论正确的是( )
下列结论正确的是( )| A. | 该有机物分子式为C13H16 | |
| B. | 该有机物分子最多有4个碳原子共直线 | |
| C. | 该有机物属于苯的同系物 | |
| D. | 该有机物分子最多有13个碳原子共平面 |
5.NA代表阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状态下,22.4L O3含有分子的数目为NA | |
| B. | 常温常压下,4.0g CH4中含有共价键的数目为NA | |
| C. | 标准状态下,2.24L Cl2与足量NaOH溶液反应,转移电子数目为0.1NA | |
| D. | 常温下,1molNa2O2所含的阴阳离子总数为4NA |
12.下列操作中,所用仪器合理的是( )
| A. | 用托盘天平称量5.22g食盐 | |
| B. | 用100mL的量筒取5.2mL稀盐酸 | |
| C. | 用100mL的容量瓶配置50mL 0.1mol/L盐酸 | |
| D. | 用25mL的酸式滴定管量取15.12mL高锰酸钾溶液 |
12.A、B是同周期元素,如果A原子半径比B大,则下列判断中正确的是( )
| A. | 两元素形成的最高价氧化物水化物的酸性A强于B | |
| B. | A的气态氢化物比B的气态氢化物稳定 | |
| C. | A的金属性比B的金属性强 | |
| D. | A的阴离子比B的阴离子还原性弱 |
 +HNO3(浓)$→_{55℃}^{浓硫酸}$
+HNO3(浓)$→_{55℃}^{浓硫酸}$ +H2O.
+H2O.
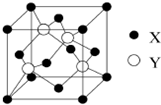 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.