题目内容
【题目】水的电离平衡曲线如图所示,下列说法中正确的是![]()
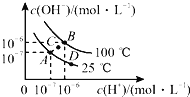
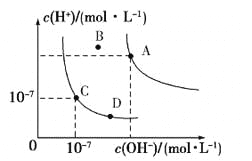
A.图中A、B、D三点处![]() 的大小关系:
的大小关系:![]()
B.若处在B点,将![]() 的硫酸与
的硫酸与![]() 的KOH溶液等体积混合,溶液显中性
的KOH溶液等体积混合,溶液显中性
C.![]() 时,保持温度不变,在水中加入适量
时,保持温度不变,在水中加入适量![]() 固体,体系可从A点变化到C点
固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在![]() 、
、![]() 、
、![]() 、
、![]()
【答案】B
【解析】
![]() 水的电离是吸热反应,温度越高水的电离程度越大,则水的离子积常数越大;根据图知,A、D两点温度相等而低于B点温度,所以A、B、D三点处
水的电离是吸热反应,温度越高水的电离程度越大,则水的离子积常数越大;根据图知,A、D两点温度相等而低于B点温度,所以A、B、D三点处![]() 的大小关系:
的大小关系:![]() ,故A错误;
,故A错误;
B.B点时,![]() 的硫酸中
的硫酸中![]() ,
,![]() 的KOH溶液中
的KOH溶液中![]() ,二者等体积混合时,酸碱恰好完全反应生成强酸强碱盐,溶液呈中性,故B正确;
,二者等体积混合时,酸碱恰好完全反应生成强酸强碱盐,溶液呈中性,故B正确;
C.向水中加入氯化铵固体,由于铵根的水解,溶液中![]() 变小,
变小,![]() 变大,溶液显酸性,但温度不变,Kw不变,氢离子和氢氧根离子的乘积仍在A点所在曲线上,故C错误;
变大,溶液显酸性,但温度不变,Kw不变,氢离子和氢氧根离子的乘积仍在A点所在曲线上,故C错误;
D.A对应的点中![]() ,溶液呈中性,A点对应的溶液中大量存在
,溶液呈中性,A点对应的溶液中大量存在![]() 、
、![]() 、
、![]() ,但
,但![]() 在溶液呈中性会生成沉淀,故D错误;
在溶液呈中性会生成沉淀,故D错误;
故选B。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
【题目】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L1·s1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。