题目内容
【题目】下图所示原电池的总反应为Cu(s)+2Ag+(aq)![]() Cu2+(aq)+2Ag(s),下列叙述正确的是
Cu2+(aq)+2Ag(s),下列叙述正确的是
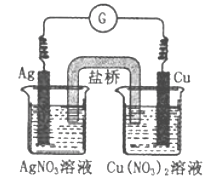
A. 电子从银电极经导线流向铜电极
B. 工作一段时间后,右烧杯中溶液的pH变小
C. 电池工作时,Cu2+向铜电极移动
D. 将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针反向偏转
【答案】A
【解析】根据总反应Cu(s)+2Ag+(aq)![]() Cu2+(aq)+2Ag(s),铜失电子发生氧化反应,铜是负极,电子从铜电极经导线流向银电极,故A错误;右烧杯中的电极反应为Cu-2e-=Cu2+,溶液的pH不变,故B错误;铜是负极,NO3-向铜电极移动,故C错误;将AgNO3溶液更换为Fe(NO3)3溶液,左烧杯中Ag-e-=Ag+,银是负极,电流计指针反向偏转,故D正确。
Cu2+(aq)+2Ag(s),铜失电子发生氧化反应,铜是负极,电子从铜电极经导线流向银电极,故A错误;右烧杯中的电极反应为Cu-2e-=Cu2+,溶液的pH不变,故B错误;铜是负极,NO3-向铜电极移动,故C错误;将AgNO3溶液更换为Fe(NO3)3溶液,左烧杯中Ag-e-=Ag+,银是负极,电流计指针反向偏转,故D正确。

 第1卷单元月考期中期末系列答案
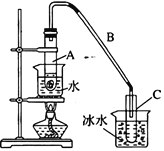
第1卷单元月考期中期末系列答案【题目】某化学小组采用类似制乙酸乙酯的装置(如右图所示),用环己醇制备环己烯。
已知: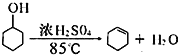
相对分子质量 | 密度/g cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇与1mL浓硫酸加入试管A中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①在试管中混合环已醇和浓硫酸操作时,加入药品的先后顺序为_________。
②如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_________(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③将试管C置于冰水中的目的是_______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。向粗品中加入饱和食盐水,振荡、静置、分层,环己烯在__________________层(填“上”或“下”),分液后用__________________(填字母)洗涤。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将提纯后的环己烯按如图所示装置进行蒸馏。图中仪器a 的名称是_______________。实验中冷却水从__________(填字母)口进入。蒸馏时要加入生石灰,目的是__________________________。
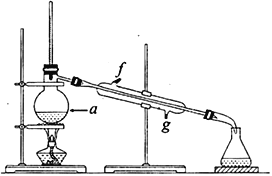
(3)若在制备粗品时环已醇随产品一起蒸出,则实验制得的环己烯精品质量__________(填“高于”、“ 低于”)理论产量。本实验所得到的环已烯质量为6.25g,则产率是___________________。