题目内容
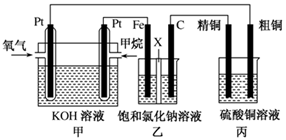
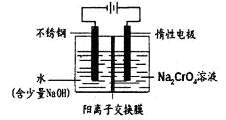
甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题: 
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
(1)① 碳(C );铁(Fe) (2分) ② 4OH――4e-=2H2O + O2↑ (2分)
(2)①2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分) ②5Cl2 + I2 + 6H2O=10HCl + 2HIO3 (2分) ③13 (2分)
2OH-+H2↑+Cl2↑(2分) ②5Cl2 + I2 + 6H2O=10HCl + 2HIO3 (2分) ③13 (2分)
解析试题分析:(1)①根据装置图可知,甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出。乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气。阴极铁电极上发生还原反应有Cu析出。
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH――4e-=2H2O + O2↑。
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,总的离子反应方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
②反应的Cl2和I2的物质的量之比为5:1,且生成两种酸,其中一种是盐酸。根据电子的得失守恒可知碘元素的化合价应该升高到+5价,所以氧化产物是碘酸,因此反应的方程式是5Cl2 + I2 + 6H2O=10HCl + 2HIO3。
③电解氯化钠溶液的方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=0.02mol÷0.2L=0.1mol/L,则pH=13。
2OH-+H2↑+Cl2↑,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=0.02mol÷0.2L=0.1mol/L,则pH=13。
考点:考查电化学反应原理的应该判断、应用和计算
点评:该题是中等难度的试题,也是高考中的常见题型。试题难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。答题时要明确不同装置中所发生的电极反应,熟悉原电池和电解池的工作原理即可解答。

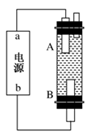
某化学兴趣小组用下图装置电解CuSO4溶液,测定铜的相对分子质量。
(1)若实验中测定在标准状况下放出的氧气的体积VL,A连接直流电源的__________ (填“正极”或“负极”)。
(2)电解开始一段时间后,在U形管中可观察到的现象-____________________________。
电解的离子方程式为 。
(3)实验中还需测定的数据是_______________(填写序号)。
①A极的质量增重m g ②B极的质量增重m g
(4)下列实验操作中必要的是____________(填字母)。
| A.称量电解前电极的质量 |
| B.电解后,电极在烘干称重前,必须用蒸馏水冲洗 |
| C.刮下电解过程中电极上析出的铜,并清洗、称重 |
| D.电极在烘干称重的操作中必须按“烘干—称重一再烘干一再称重”进行 |
(5)铜的相对原子质量为:_______________________(用含有m、V的计算式表示)。
(6)如果用碱性(KOH为电解质)甲醇燃料电池作为电源进行实验,放电时负极的电极反应式为 。
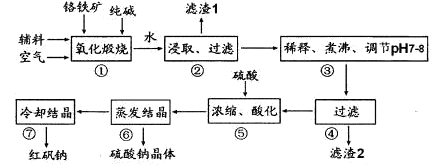
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: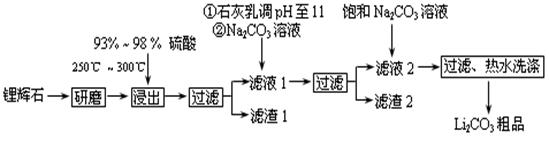
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓) Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式: 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是 。

 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。