��Ŀ����
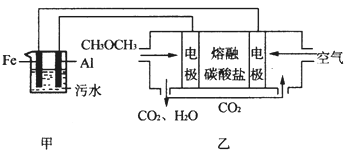
��12�֣���ͼ��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ���밴Ҫ��ش�������⣺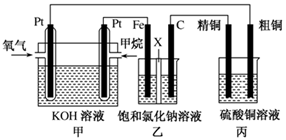
(1)����ȼ�ϵ�ظ�����Ӧʽ�� ��
(2)ʯī(C)���ĵ缫��ӦʽΪ ��
(3)���ڱ�״���£���2.24 L�����μӷ�Ӧ������װ�������������� ���������Ϊ________L ����װ������������ͭ������Ϊ________g ��
(4)ijͬѧ���ü���ȼ�ϵ����Ƶ�ⷨ��ȡƯ��Һ��Fe(OH)2��ʵ��װ��(��ͼ��ʾ)��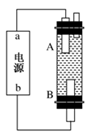
��������Ư��Һ��aΪ��ص�________�����������Һ�����________����������Fe(OH)2��ʹ�����������������Һ������ѡ��________���缫��
��12�֣� (1) CH4 +10OH- -8e����CO32-+7H2O ����3�֣�
(2)2Cl����2e����Cl2������2�֣� (3)4.48L����2�֣���12.8g����2�֣�
(4) ����1�֣��������Ȼ�����Һ��ʳ��ˮ��1�֣� �� ��1�֣�
�������������ȼ�ϵ���У�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫��������
��1��ȼ�ϵ���У�������Ͷ��ȼ�ϣ�����Ͷ�ż���ĵ缫�Ǹ�����������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CH4+10OH--8e-��CO32-+7H2O��
��2������Ͷ���������ĵ缫��������������װ����ʯī�缫��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��2Cl--2e-��Cl2����
��3�����������ת�Ƶ�������ȣ����ڱ�״���£���2.24L�����μӷ�Ӧ�����������ʵ�����2.24L��22.4L/mol��0.1mol������ת�Ƶ��ӵ����ʵ�����0.1mol��4��0.4mol����װ�������缫�������ӷŵ��������������������������ΪxL����װ��������������ͭ��������ͭ������Ϊyg����
2H++2e-��H2��
2mol 22.4L
0.4mol xL
���x=4.48
Cu 2++2e-��Cu
2mol 64g
0.4mol yg
���y=12.8
��4����ⱥ��ʳ��ˮʱ�����������������������������������������������Ʒ�Ӧ���ɴ������ƣ�����������Ư��Һ����Ч�ɷ֣�B�缫�������������������ܶ�С����Һ���ܶȣ��������ɵ������������ܺ�����������Һ��ֵĽӷ�Ӧ���ɴ������ƣ�����A����������������A��������������aΪ��ظ�������������Fe��OH��2��ʹ�����������������Һ�������������ӷŵ�������������������Ƕ��Ե缫�����������������ӷŵ����������ò�������������������������Ӧ������ʧ���������������ӣ��������Ӻ��������Ʒ�Ӧ����������������
���㣺����ԭ��غ͵���ԭ�������ʵ������йؼ���

�����й�ʵ��װ�ü���;������ȫ��ȷ����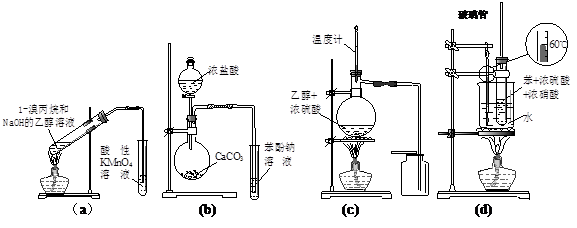

| A��aװ�ü�����ȥ����м�Ӧ��ˮϴװ�� | B��bװ�ü������ԣ����̼����� |
| C��cװ������ʵ������ȡ���ռ���ϩ | D��dװ������ʵ������������ |