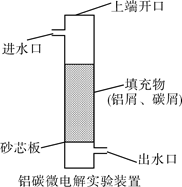
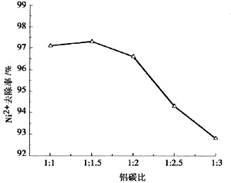
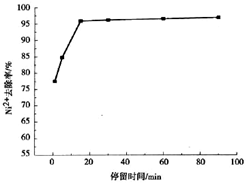
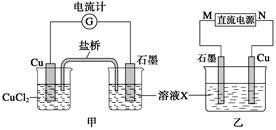
题目内容
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: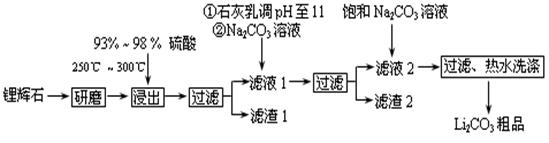
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓)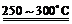 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
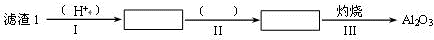
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式: 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
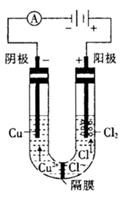
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是 。
(15分)(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+或Al3++3OH-=Al(OH)3↓ (3分)
(2)Mg2+ + 2OH-=Mg(OH)2↓、 Ca2++CO32-=CaCO3↓ (共4分)
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(3分)
(4)①2Cl――2e-=Cl2↑(2分) ②2LiOH+2NH4HCO3=Li2CO3↓+ (NH4)2CO3+2H2O(3分)
解析试题分析:(1)锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素),加入硫酸浸出发生的反应为:Li2O·A12O3·4SiO2+H2SO4(浓) Li2SO4+Al2O3?4SiO2?H2O↓,由此推断滤渣是Al2O3?4SiO2?H2O。由于氧化铝是两性氧化物,所以分离得到氧化铝可以先加入盐酸溶解氧化铝,二氧化硅不反应,过滤得到氯化铝溶液,加入过量氨水会完全沉淀铝离子生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,最后灼烧氢氧化铝得到氧化铝,由此步骤Ⅱ中反应的离子方程式是Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
Li2SO4+Al2O3?4SiO2?H2O↓,由此推断滤渣是Al2O3?4SiO2?H2O。由于氧化铝是两性氧化物,所以分离得到氧化铝可以先加入盐酸溶解氧化铝,二氧化硅不反应,过滤得到氯化铝溶液,加入过量氨水会完全沉淀铝离子生成氢氧化铝沉淀,过滤得到氢氧化铝沉淀,最后灼烧氢氧化铝得到氧化铝,由此步骤Ⅱ中反应的离子方程式是Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(2)滤液1中含有Mg2+、Ca2+,所以加入氢氧化钙和碳酸钠以后会生成氢氧化镁和碳酸钙沉淀,有关反应的离子方程式为Mg2+ + 2OH-=Mg(OH)2↓、Ca2++CO32-=CaCO3↓。
(3)根据表中数据可知,Li2CO3的溶解度随温度升高而减小,由此热水洗涤可减少Li2CO3的损失。
(4)①电解池阳极失去电子,所以该电解池中阳极应该是溶液中的氯离子失去电子,所以阳极电极反应式为2Cl――2e-=Cl2↑。
②LiOH是强碱,HCO3-结合OH-能力强于NH4+,所以LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3↓+(NH4)2CO3+2H2O。
考点:考查物质制备实验方案设计与评价、物质的分离与提纯、电极反应式的书写等