题目内容
17.化学在生产和日常生活中有着重要的应用.下列叙述中错误的有( )①汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
②干冰或碘化银可用于人工降雨
③工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的还原性比硅强
④氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应”
⑤漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
分析 ①汽油中不含氮元素;
②干冰升华和碘化银易分解过程都吸收热量;
③根据单质之间的置换反应可以确定还原性的强弱;
④氟利昂破坏臭氧层,导致臭氧空洞;
⑤次氯酸钙具有强氧化性,能杀菌消毒,且具有漂白性;
解答 解:①汽油中不含氮元素,汽车尾气中的氮氧化物是空气中的氮气与氧气在高温下生成的,故错误;
②干冰升华和碘化银易分解过程都吸收热量,从而使空气中的水蒸气变小液滴,故正确;
③工业上,焦炭在高温下还原二氧化硅得到粗硅和一氧化碳,根据元素周期律知识,还原性C<Si,故错误;
④氟利昂破坏臭氧层,导致臭氧空洞,而温室效应与二氧化碳的排放有关,故错误;
⑤次氯酸钙具有强氧化性,能使蛋白质变性而杀菌消毒,同时也具有漂白性,所以漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故正确;
故选:C.
点评 本题化学在生产生活中的应用,熟悉相关物质的性质是解题关键,题目难度不大,注意对知识的积累.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
9.在一固定体积的密闭容器中加入2mol A和1mol B发生反应2A(g)+B(g)?3C(g)+D(g),达到平衡时C的浓度为w mol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol•L-1的配比是( )
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |
6.有4种碳骨架如下的烃,下列说法不正确的是( )

| A. | a和d互为同素异形体 | B. | b和c互为同系物 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |
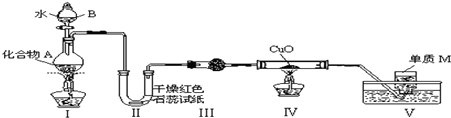
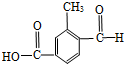 (1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团:
(1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团: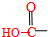 和
和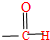 (填化学式),所以这个化合物看作羧酸类和醛类.
(填化学式),所以这个化合物看作羧酸类和醛类.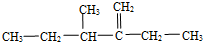 ,此烃的名称为3-甲基-2-乙基-1-戊烯
,此烃的名称为3-甲基-2-乙基-1-戊烯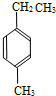 ,此烃名称为对甲基乙苯或4-甲基乙基苯
,此烃名称为对甲基乙苯或4-甲基乙基苯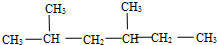 .
.
 .(不用写反应条件)
.(不用写反应条件)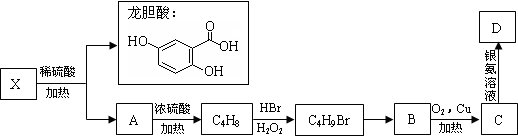
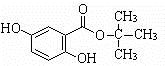 .
.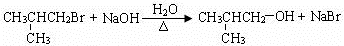 .(用结构简式表示)
.(用结构简式表示)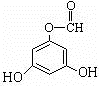 或
或 .
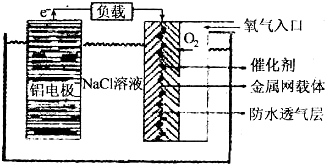
.
 .
. .
.